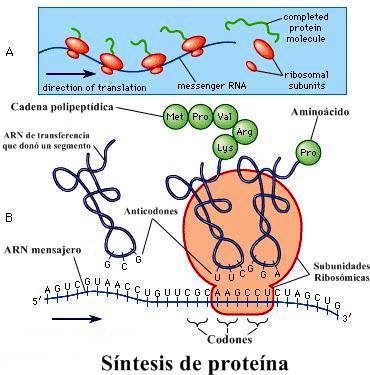
Proteínas: definición, clasificación, funciones, importancia, estructura y propiedades a nivel bioquímico y fisiológico
Definición, clasificación, funciones, importancia, estructura general y características de las proteínas a nivel bioquímico y fisiológico. Las Proteínas son sustancias altamente complejas que están presentes en todos los organismos vivos.
Las proteínas son de gran valor nutritivo y están directamente involucradas en los procesos químicos esenciales para la vida como por ejemplo en los relacionados con el transporte de oxígeno (por medio de la hemoglobina contenida en los eritrocitos o glóbulos rojos) y nutrientes a todas las células del organismo, también están involucradas en los procesos de digestión (las enzimas tienen característica proteínica), de reparación del tejido muscular esquelético, etc.
Importancia y características de las proteínas
La importancia de las proteínas en el organismo fue reconocida por los químicos a principios del siglo XIX, incluyendo el químico sueco Jöns Jacob Berzelius, quien en 1838 acuñó el término "Proteína", una palabra derivada del griego "proteios", que significa "mantener el primer lugar".
Es decir, las proteínas de una especie difieren de las de otra especie. También son específicas de órganos; Por ejemplo, dentro de un solo organismo, las proteínas musculares difieren de las del cerebro y de las del hígado.
Una molécula de proteína es muy grande en comparación con las moléculas de azúcar o sal y consta de muchos aminoácidos unidos entre sí para formar cadenas largas, al igual que las perlas se disponen en una cuerda para formar un collar. Hay cerca de 20 aminoácidos diferentes que se producen naturalmente en las proteínas.
Las proteínas de función similar tienen una composición y secuencia de aminoácidos similares. Aunque todavía no es posible explicar todas las funciones de una proteína según su secuencia de aminoácidos... las correlaciones establecidas entre estructura y función se pueden atribuir a las propiedades de los aminoácidos que componen las proteínas.
Las plantas pueden sintetizar todos los aminoácidos; Los animales no pueden, aunque todos ellos son esenciales para la vida. Las plantas pueden crecer en un medio que contiene nutrientes inorgánicos que proporcionan nitrógeno, potasio y otras sustancias esenciales para el crecimiento. Utilizan el dióxido de carbono en el aire durante el proceso de la fotosíntesis para formar compuestos orgánicos tales como los carbohidratos.
Los animales, sin embargo, deben obtener nutrientes orgánicos de fuentes externas, en este caso hablando más concretamente de los aminoácidos que servirían para sintetizar proteínas dentro del cuerpo. Debido a que el contenido de proteína de la mayoría de las plantas es bajo, cantidades muy grandes de material vegetal son requeridas por los animales, tales como rumiantes (por ejemplo, vacas), que comen solo material vegetal para satisfacer sus requerimientos de aminoácidos.
Los animales no rumiantes, incluidos los humanos, obtienen proteínas principalmente de animales y sus productos, por ejemplo, carne, leche y huevos. Las semillas de leguminosas se utilizan cada vez más para preparar alimentos ricos en proteínas de bajo costo.
El contenido de proteínas de los órganos de los animales suele ser mucho mayor que el del plasma sanguíneo. Los músculos, por ejemplo, contienen alrededor del 30 por ciento de proteína, el hígado del 20 al 30 por ciento y los glóbulos rojos alrededor del 30 por ciento. Los porcentajes más altos de proteína se encuentran en el cabello, huesos y otros órganos y tejidos con un bajo contenido de agua.
La cantidad de aminoácidos y péptidos libres en animales es mucho menor que la cantidad de proteína; Las moléculas de proteína se producen en las células por la alineación escalonada de aminoácidos y se liberan en los fluidos corporales sólo después de que la síntesis es completada.
El alto contenido en proteínas de algunos órganos no significa que la importancia de las proteínas esté relacionada con su cantidad en un organismo o tejido; Por el contrario, algunas de las proteínas más importantes, tales como las enzimas y hormonas, se producen en cantidades extremadamente pequeñas. La importancia de las proteínas está relacionada principalmente con su función. Todas las enzimas identificadas hasta el momento son proteínas.
Las enzimas, que son los catalizadores de todas las reacciones metabólicas, permiten a un organismo acumular las sustancias químicas necesarias para la vida - proteínas, ácidos nucleicos, hidratos de carbono y lípidos - para convertirlas en otras sustancias y degradarlas. La vida sin enzimas no es posible. Existen varias hormonas proteicas con importantes funciones reguladoras.
En todos los vertebrados, la proteína respiratoria hemoglobina actúa como transportador de oxígeno en la sangre, llevando el oxígeno desde el pulmón hasta los órganos del cuerpo y los tejidos. Un gran grupo de proteínas estructurales mantiene y protege la estructura del cuerpo de los animales y por supuesto de los humanos.
Estructura general y propiedades de las proteínas
La composición de aminoácidos de las proteínas
La propiedad común de todas las proteínas es que consisten en cadenas largas de α-amino (alfa amino) ácidos. Estructura general de los α-aminoácidos: los α-aminoácidos se llaman así porque el átomo de carbono α de la molécula lleva un grupo amino (-NH2); El átomo de carbono α también lleva un grupo carboxilo (-COOH).

En soluciones ácidas, cuando el pH es inferior a 4, los grupos -COO se combinan con iones hidrógeno (H +) y se convierten así en la forma no cargada (-COOH). En soluciones alcalinas, a pH por encima de 9, los grupos amonio (-NH + 3) pierden un ion hidrógeno y se convierten en grupos amino (-NH2). En el rango de pH entre 4 y 8, los aminoácidos llevan una carga positiva y otra negativa y por lo tanto no emigran en un campo eléctrico. Tales estructuras han sido designadas como iones dipolares, o zwitteriones (es decir, iones híbridos).
Aunque más de 100 aminoácidos se producen en la naturaleza, especialmente en las plantas, sólo 20 tipos de éstos se encuentran comúnmente en la mayoría de las proteínas. En moléculas de proteínas, los α-aminoácidos están unidos entre sí por enlaces peptídicos entre el grupo amino de un aminoácido y el grupo carboxilo de su vecino.
La condensación (unión) de tres aminoácidos produce el tripéptido
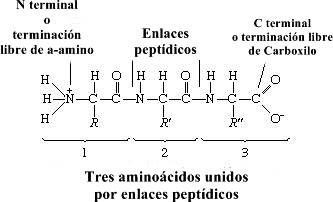
Es habitual escribir la estructura de péptidos de tal manera que el grupo α-amino libre (también llamado N terminal del péptido) esté en el lado izquierdo y el grupo carboxilo libre (el extremo C) en el lado derecho. Las proteínas son polipéptidos macromoleculares, es decir, moléculas muy grandes compuestas de muchos aminoácidos unidos por péptidos. La mayoría de los más comunes contienen más de 100 aminoácidos unidos entre sí en una larga cadena peptídica.
El peso molecular medio (basado en el peso de un átomo de hidrógeno como 1) de cada aminoácido es de aproximadamente 100 a 125; Por lo tanto, los pesos moleculares de las proteínas están usualmente en el intervalo de 10.000 a 100.000 daltons (un dalton es el peso de un átomo de hidrógeno).
La especificidad de las especies y la especificidad de los órganos de las proteínas resultan de las diferencias en el número y secuencias de aminoácidos. Veinte aminoácidos diferentes en una cadena de 100 aminoácidos de longitud se pueden organizar en mucho más de 10^100 maneras (10^100 es el número uno seguido de 100 ceros).
Estructuras de aminoácidos comunes
Los aminoácidos presentes en las proteínas difieren entre sí en la estructura de sus cadenas laterales (R). El aminoácido más sencillo es la glicina, en la que R es un átomo de hidrógeno. En varios aminoácidos, R representa cadenas de carbono lineales o ramificadas. Uno de estos aminoácidos es la alanina, en la que R es el grupo metilo (-CH3). Valina, leucina e isoleucina, con grupos R más largos, completan la serie de cadena lateral de alquilo.
Las cadenas laterales de alquilo (grupos R) de estos aminoácidos son no polares; Esto significa que no tienen afinidad por el agua, sino alguna afinidad entre sí. Aunque las plantas pueden formar todos los aminoácidos de alquilo, los animales pueden sintetizar solamente alanina y glicina; Por lo tanto valina, leucina e isoleucina deben ser suministrados en la dieta y por ende son considerados como aminoácidos esenciales.
Dos aminoácidos, cada uno con tres átomos de carbono, se derivan de alanina; Son serina y cisteína. La serina contiene un grupo alcohol (-CH _ {2} OH) en lugar del grupo metilo de alanina, y la cisteína contiene un grupo mercapto (-CH _ {2} SH). Los animales pueden sintetizar serina pero no cisteína o cistina.
La cisteína se encuentra en proteínas, predominantemente en su forma oxidada (oxidación en este sentido que significa la eliminación de átomos de hidrógeno), llamada cistina. La cistina consiste en dos moléculas de cisteína unidas por el enlace disulfuro (-S-S-) que resulta cuando se elimina un átomo de hidrógeno del grupo mercapto de cada una de las cisteínas.
Los enlaces disulfuro son importantes en la estructura proteica porque permiten la unión de dos partes diferentes de una molécula de proteína a la formación de bucles en las cadenas por lo demás rectas. Algunas proteínas contienen pequeñas cantidades de cisteína con grupos sulfhidrilo (-SH) libres.

Cuatro aminoácidos, cada uno de ellos formado por cuatro átomos de carbono, se producen en las proteínas; Estos son: ácido aspártico, asparagina, treonina y metionina. El ácido aspártico y la asparagina, que se producen en grandes cantidades, pueden ser sintetizados por los animales. La treonina y la metionina no pueden ser sintetizadas y, por lo tanto, son aminoácidos esenciales; Es decir, deben ser suministrados en la dieta. La mayoría de las proteínas contienen sólo pequeñas cantidades de metionina.
Las proteínas también contienen un aminoácido con cinco átomos de carbono (ácido glutámico) y una amina secundaria (prolina), que es una estructura con el grupo amino (-NH2) unido a la cadena lateral de alquilo, formando un anillo. El ácido glutámico y el ácido aspártico son ácidos dicarboxílicos; Es decir, tienen dos grupos carboxilo (-COOH).

La glutamina es similar a la asparagina en que ambas son las amidas de sus correspondientes formas de ácido dicarboxílico; Es decir, tienen un grupo amida (-CONH2) en lugar del carboxilo (-COOH) de la cadena lateral.
El ácido glutámico y la glutamina son abundantes en la mayoría de las proteínas; Por ejemplo, en proteínas vegetales a veces comprenden más de un tercio de los aminoácidos presentes. Tanto el ácido glutámico como la glutamina pueden ser sintetizados por los animales.
Los aminoácidos prolina e hidroxiprolina se producen en grandes cantidades en colágeno, la proteína del tejido conectivo de los animales. La prolina y la hidroxiprolina carecen de grupos amino libres (-NH2) porque el grupo amino está encerrado en una estructura de anillo con la cadena lateral; Por lo tanto, no pueden existir en forma de zwitterión.
Aunque el grupo que contiene nitrógeno (> NH) de estos aminoácidos puede formar un enlace peptídico con el grupo carboxilo de otro aminoácido, el enlace así formado da lugar a una curvatura en la cadena peptídica; Es decir, la estructura del anillo altera el ángulo de unión regular de los enlaces peptídicos normales.
Las proteínas suelen ser moléculas casi neutras; Es decir, no tienen propiedades ácidas ni básicas. Esto significa que los grupos carboxilo (-COO-) ácidos del ácido aspártico y glutámico son aproximadamente iguales en número a los aminoácidos con cadenas laterales básicas. Tres de estos aminoácidos básicos, cada uno con seis átomos de carbono, se producen en proteínas. La que tiene la estructura más simple, la lisina, es sintetizada por las plantas pero no por los animales.
Incluso algunas plantas tienen un bajo contenido de lisina. La arginina se encuentra en todas las proteínas; Se produce en cantidades particularmente altas en las protaminas fuertemente básicas (proteínas simples compuestas de relativamente pocos aminoácidos) de espermatozoides de peces.
El tercer aminoácido básico es la histidina. Tanto la arginina como la histidina pueden ser sintetizadas por los animales. La histidina es de una base más débil que la lisina o la arginina. El anillo de imidazol, una estructura de anillo de cinco miembros que contiene dos átomos de nitrógeno en la cadena lateral de histidina, actúa como un tampón (es decir, un estabilizador de la concentración de iones hidrógeno) uniendo iones de hidrógeno (H +) a los átomos de nitrógeno del anillo de imidazol.

Los restantes aminoácidos - fenilalanina, tirosina y triptófano - tienen en común una estructura aromática; Es decir, está presente un anillo de benceno. Estos tres aminoácidos son esenciales, y, mientras que los animales no pueden sintetizar el propio anillo de benceno, pueden convertir la fenilalanina en tirosina.

Propiedades fisicoquímicas de los aminoácidos
Las propiedades fisicoquímicas de una proteína se determinan por las propiedades análogas de los aminoácidos en ella.
El átomo de carbono α de todos los aminoácidos, con la excepción de la glicina, es asimétrico; Esto significa que cuatro entidades químicas diferentes (átomos o grupos de átomos) se unen a ella.
Como resultado, cada uno de los aminoácidos, excepto la glicina, puede existir en dos disposiciones espaciales o geométricas diferentes (es decir, isómeros), que son imágenes espejo similares a las manos derecha e izquierda.
Estos isómeros exhiben la propiedad de la rotación óptica. La rotación óptica es la rotación del plano de la luz polarizada, la cual está compuesta por ondas luminosas que vibran en un solo plano o dirección. Se dice que las soluciones de sustancias que giran el plano de polarización son ópticamente activas, y el grado de rotación se denomina rotación óptica de la solución.
La dirección en la que gira la luz se diseña generalmente como más, o d, para dextrorotatory (a la derecha), o como menos, o l, para levorotatory (a la izquierda). Algunos aminoácidos son dextrorotatory, otros son levorotatory. Con la excepción de unas pocas proteínas pequeñas (péptidos) que se producen en las bacterias, los aminoácidos que se producen en las proteínas son l-aminoácidos.

En bacterias, se han encontrado d-alanina y algunos otros d-aminoácidos como componentes de gramicidina y bacitracina. Estos péptidos son tóxicos para otras bacterias y se usan en medicina como antibióticos. La d-alanina también se ha encontrado en algunos péptidos de membranas bacterianas.
En contraste con la mayoría de los ácidos orgánicos y aminas, los aminoácidos son insolubles en disolventes orgánicos. En soluciones acuosas son iones dipolares (iones híbridos o híbridos) que reaccionan con ácidos o bases fuertes de una manera que conduce a la neutralización de los extremos cargados negativamente o positivamente, respectivamente.
Debido a sus reacciones con ácidos fuertes y bases fuertes, los aminoácidos actúan como amortiguadores-estabilizadores de las concentraciones de iones hidrógeno (H +) o hidróxido (OH-).
De hecho, la glicina se utiliza frecuentemente como un tampón en el intervalo de pH de 1 a 3 (soluciones ácidas) y de 9 a 12 (soluciones básicas). En soluciones ácidas, la glicina tiene una carga positiva y por lo tanto migra al cátodo (electrodo negativo de un circuito eléctrico de corriente continua con terminales en la solución).
Su carga, sin embargo, es negativa en soluciones alcalinas, en las que migra al ánodo (electrodo positivo). A pH 6.1, la glicina no migra, ya que cada molécula tiene una carga positiva y otra negativa.
El pH al que un aminoácido no emigra en un campo eléctrico se denomina punto isoeléctrico. La mayoría de los monoaminoácidos (es decir, aquellos con sólo un grupo amino) tienen puntos isoeléctricos similares a los de la glicina. Los puntos isoeléctricos de los ácidos aspártico y glutámico, sin embargo, están cerca de pH 3, y los de histidina, lisina y arginina están a pH 7,6, 9,7 y 10,8, respectivamente.
Secuencia de aminoácidos en moléculas de proteínas
Dado que cada molécula de proteína consiste en una cadena larga de residuos de aminoácidos, unidos entre sí por enlaces peptídicos, la escisión hidrolítica de todos los enlaces peptídicos es un requisito previo para la determinación cuantitativa de los residuos de aminoácidos. La hidrólisis se realiza más frecuentemente hirviendo la proteína con ácido clorhídrico concentrado.
La determinación cuantitativa de los aminoácidos se basa en el descubrimiento de que los aminoácidos pueden separarse entre sí por cromatografía sobre papel de filtro y hacerse visible por pulverización del papel con ninhidrina.
Los aminoácidos del hidrolizado de proteínas se separan entre sí haciendo pasar el hidrolizado a través de una columna de adsorbentes, que adsorben los aminoácidos con diferentes afinidades y, al lavar la columna con soluciones tampón, los liberan en un orden definido. La cantidad de cada uno de los aminoácidos puede determinarse por la intensidad de la reacción de color con ninhidrina.
Para obtener información sobre la secuencia de los residuos de aminoácidos en la proteína, la proteína se degrada gradualmente, separándose un aminoácido en cada paso. Esto se consigue acoplando el grupo α-amino libre (-NH2) del aminoácido N-terminal con isotiocianato de fenilo; La hidrólisis suave posterior no afecta a los enlaces peptídicos. El procedimiento, llamado la degradación de Edman, se puede aplicar repetidamente; Por lo tanto, revela la secuencia de los aminoácidos en la cadena peptídica.
Las inevitables pequeñas pérdidas que se producen durante cada paso hacen imposible determinar la secuencia de más de aproximadamente 30 a 50 aminoácidos por este procedimiento.
Por esta razón, la proteína normalmente se hidroliza primero mediante la exposición a la enzima tripsina, que escinde solamente los enlaces peptídicos formados por los grupos carboxilo de lisina y arginina. La degradación de Edman se aplica entonces a cada uno de los pocos péptidos resultantes producidos por la acción de la tripsina.
Se puede obtener más información hidrolizando otra porción de la proteína con otra enzima, por ejemplo con quimotripsina, que divide predominantemente enlaces peptídicos formados por los aminoácidos tirosina, fenilalanina y triptófano.
La combinación de los resultados obtenidos con dos o más diferentes enzimas proteolíticas (degradación de proteínas) fue aplicado por primera vez por el bioquímico inglés Frederick Sanger, y le permitió elucidar la secuencia de aminoácidos de la insulina. Las secuencias de aminoácidos de muchas otras proteínas se determinaron posteriormente de la misma manera.
Niveles de organización estructural en proteínas
- Estructura primaria
Los procedimientos analíticos y sintéticos revelan sólo la estructura primaria de las proteínas, es decir, la secuencia de aminoácidos de las cadenas peptídicas. No revelan información sobre la conformación (disposición en el espacio) de la cadena peptídica, es decir, si la cadena peptídica está presente como un hilo recto largo o está enrollada de forma irregular y plegada en un glóbulo.
La configuración o conformación de una proteína se determina por atracción mutua o repulsión de grupos polares o no polares en las cadenas laterales (grupos R) de los aminoácidos. Los primeros tienen cargas positivas o negativas en sus cadenas laterales; Estos últimos repelen el agua pero se atraen entre sí.
Algunas partes de una cadena peptídica que contiene de 100 a 200 aminoácidos pueden formar un bucle, o hélice; Otros pueden ser rectos o formar bobinas irregulares.
Los términos estructura secundaria, terciaria y cuaternaria se aplican frecuentemente a la configuración de la cadena peptídica de una proteína. Un comité de nomenclatura de la Unión Internacional de Bioquímica (IUB) ha definido estos términos como sigue: La estructura primaria de una proteína se determina por su secuencia de aminoácidos sin tener en cuenta la disposición de la cadena peptídica en el espacio.
La estructura secundaria está determinada por la disposición espacial de la cadena peptídica principal sin tener en cuenta la conformación de cadenas laterales u otros segmentos de la cadena principal.
La estructura terciaria está determinada tanto por las cadenas laterales como por otros segmentos adyacentes de la cadena principal, sin tener en cuenta las cadenas peptídicas vecinas. Finalmente, el término estructura cuaternaria se usa para la disposición de subunidades idénticas o diferentes de una proteína grande en la que cada subunidad es una cadena peptídica separada.
- Estructura secundaria
Los átomos de nitrógeno y de carbono de una cadena peptídica no pueden estar sobre una línea recta, debido a la magnitud de los ángulos de unión entre átomos adyacentes de la cadena; El ángulo de unión es de aproximadamente 110º. Sin embargo, cada uno de los átomos de nitrógeno y de carbono puede girar hasta cierto punto, de modo que la cadena tiene una flexibilidad limitada.
Debido a que todos los aminoácidos, excepto la glicina, son l-aminoácidos asimétricos, la cadena peptídica tiende a asumir una forma helicoidal asimétrica; Algunas de las proteínas fibrosas consisten en hélices alargadas alrededor de un eje de tornillo recto. Tales características estructurales resultan de propiedades comunes a todas las cadenas peptídicas. El producto de sus efectos es la estructura secundaria de la proteína.
- Estructura terciaria
La estructura terciaria es el producto de la interacción entre las cadenas laterales (R) de los aminoácidos que componen la proteína. Algunos de ellos contienen grupos cargados positivamente o negativamente, otros son polares y otros son no polares.
El número de átomos de carbono en la cadena lateral varía de cero en glicina a nueve en triptófano. Las cadenas laterales positivas y cargadas negativamente tienen la tendencia a atraerse entre sí; Las cadenas laterales con cargas idénticas se repelen entre sí.
Los enlaces formados por las fuerzas entre las cadenas laterales cargadas negativamente del ácido aspártico o glutámico, por una parte, y las cadenas laterales positivamente cargadas de lisina o arginina, por otra parte, se llaman puentes salinos. La atracción mutua de cadenas peptídicas adyacentes también resulta de la formación de numerosos enlaces de hidrógeno.

Los enlaces de hidrógeno se forman como resultado de la atracción entre el átomo de hidrógeno unido al nitrógeno (el hidrógeno de imida) y el par de electrones no compartidos del átomo de oxígeno en el grupo carbono-oxígeno doblemente unido (el grupo carbonilo). El resultado es un ligero desplazamiento de la imida de hidrógeno hacia el átomo de oxígeno del grupo carbonilo.
Aunque el enlace de hidrógeno es mucho más débil que un enlace covalente (es decir, el tipo de enlace entre dos átomos de carbono, que comparten igualmente el par de electrones de unión entre ellos), el gran número de grupos imida y carbonilo en cadenas peptídicas da lugar a la formación De numerosos enlaces de hidrógeno. Otro tipo de atracción es la que existe entre cadenas laterales no polares de valina, leucina, isoleucina y fenilalanina; La atracción resulta en el desplazamiento de moléculas de agua y se llama interacción hidrófoba.
En proteínas ricas en cistina, la conformación de la cadena peptídica se determina en gran medida por los enlaces disulfuro (-S-S-) de la cistina. Las mitades de cistina pueden estar localizadas en diferentes partes de la cadena peptídica y por lo tanto pueden formar un bucle cerrado por el enlace disulfuro.

Si se reduce el enlace disulfuro (es decir, se añade hidrógeno) a dos grupos sulfhidrilo (-SH), la estructura terciaria de la proteína sufre un cambio drástico: los bucles cerrados se rompen y las cadenas peptídicas adyacentes unidas por disulfuro se separan.
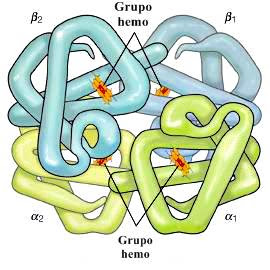
- Estructura cuaternaria
La naturaleza de la estructura cuaternaria se demuestra por la estructura de la hemoglobina. Cada molécula de hemoglobina humana consiste en cuatro cadenas peptídicas, dos cadenas α y dos cadenas β; Es decir, es un tetrámero. Las cuatro subunidades están unidas entre sí por enlaces de hidrógeno e interacción hidrófoba.
Debido a que las cuatro subunidades están tan estrechamente unidas, el tetrámero de hemoglobina se llama molécula, aunque no se producen enlaces covalentes entre las cadenas peptídicas de las cuatro subunidades. En otras proteínas, las subunidades están unidas entre sí por enlaces covalentes (puentes disulfuro).
A continuación se muestra la secuencia de aminoácidos de la proinsulina porcina. Las flechas indican la dirección desde el extremo N de la cadena β (B) al extremo C de la cadena α-

El aislamiento y determinación de proteínas
El material animal generalmente contiene grandes cantidades de proteínas y lípidos y pequeñas cantidades de carbohidratos; En las plantas, la mayor parte de la materia seca suele ser hidratos de carbono.
Si es necesario determinar la cantidad de proteína en una mezcla de alimentos animales, se convierte una muestra en sales de amonio por ebullición con ácido sulfúrico y un catalizador inorgánico adecuado, tal como sulfato de cobre (método Kjeldahl). El método se basa en el supuesto de que las proteínas contienen 16 por ciento de nitrógeno, y que el nitrógeno no proteico está presente en cantidades muy pequeñas.
La hipótesis se justifica para la mayoría de los tejidos de los animales superiores, pero no para los insectos y crustáceos, en los que una parte considerable del nitrógeno corporal está presente en forma de quitina, un carbohidrato. También se encuentran grandes cantidades de nitrógeno no proteico en la savia de muchas plantas. En tales casos, los análisis cuantitativos precisos se hacen después de que las proteínas se han separado de otros compuestos biológicos.
Las proteínas son sensibles al calor, ácidos, bases, disolventes orgánicos y exposición a la radiación; Por esta razón, los métodos químicos empleados para purificar compuestos orgánicos no pueden aplicarse a proteínas.
Las sales y moléculas de pequeño tamaño se eliminan de las soluciones de proteínas mediante diálisis, es decir, colocando la solución en un saco de material semipermeable, tal como celulosa o acetilcelulosa, que permitirá que moléculas pequeñas pasen a través de moléculas de proteína no grandes, y sumergir la En agua o en una solución salina.
Las moléculas pequeñas también pueden eliminarse pasando la solución de proteína a través de una columna de resina que adsorbe solamente la proteína o por filtración en gel. En la filtración en gel, las moléculas de proteínas grandes pasan a través de la columna, y las moléculas pequeñas se adsorben al gel.
Los grupos de proteínas se separan entre sí por salificación, es decir, la adición escalonada de sulfato de sodio o sulfato de amonio a una solución de proteína. Algunas proteínas, llamadas globulinas, se vuelven insolubles y precipitan cuando la solución está medio saturada con sulfato de amonio o cuando su contenido de sulfato de sodio excede aproximadamente el 12 por ciento.
Otras proteínas, las albúminas, pueden precipitarse de la solución sobrenadante (es decir, la solución que queda después de que se haya producido una precipitación) por saturación con sulfato de amonio. Las proteínas solubles en agua se pueden obtener en estado seco mediante liofilización (liofilización), en la que la solución de proteína se congela por reducción de la temperatura por debajo de -15ºC (5ºF) y eliminación del agua; La proteína se obtiene como un polvo seco.
La mayoría de las proteínas son insolubles en agua hirviendo y son desnaturalizadas por ella, es decir, irreversiblemente convertidas en un material insoluble. La desnaturalización por calor no se puede usar con tejido conectivo porque la proteína estructural principal, el colágeno, se convierte por agua hirviendo en gelatina soluble en agua.
La fraccionación (separación en componentes) de una mezcla de proteínas de diferente peso molecular se puede conseguir por filtración en gel. El tamaño de las proteínas retenidas por el gel depende de las propiedades del gel. Las proteínas retenidas en el gel se eliminan de la columna mediante soluciones de una concentración adecuada de sales e iones hidrógeno.
Muchas proteínas se obtuvieron originalmente en forma cristalina, pero la cristalinidad no es prueba de pureza; Muchas preparaciones de proteínas cristalinas contienen otras sustancias. Se utilizan varias pruebas para determinar si una preparación proteica contiene sólo una proteína. La pureza de una solución de proteína se puede determinar mediante técnicas tales como cromatografía y filtración en gel.
Además, una solución de proteína pura dará un pico cuando se centrifuga en una centrífuga a muy alta velocidad (ultracentrifugación) y migrará como una sola banda en electroforesis (migración de la proteína en un campo eléctrico).
Después de estos métodos y otros (como el análisis de aminoácidos) indican que la solución de proteína es pura, se puede considerar así. Debido a que la cromatografía, la ultracentrifugación y la electroforesis no pueden aplicarse a proteínas insolubles, poco se sabe sobre ellas; Pueden ser mezclas de muchas proteínas similares.
Se conocen diferencias muy pequeñas (microheterogéneas) en algunas de las proteínas aparentemente puras. Son diferencias en la composición de aminoácidos de proteínas por lo demás idénticas y se transmiten de generación en generación; Es decir, se determinan genéticamente. Por ejemplo, algunos humanos tienen dos hemoglobinas, la hemoglobina A y la hemoglobina S, que difieren en un aminoácido en un sitio específico de la molécula.
En la hemoglobina A el sitio está ocupado por ácido glutámico y en hemoglobina S por valina. El refinamiento de las técnicas de análisis de proteínas ha resultado en el descubrimiento de otras instancias de microheterogeneidad.
La cantidad de una proteína pura puede determinarse pesando o midiendo la absorbancia ultravioleta a 280 nanómetros. La absorbencia a 280 nanómetros depende del contenido de tirosina y triptófano en la proteína.
A veces se utiliza la reacción de biuret ligeramente menos sensible, un color púrpura dado por soluciones de proteínas alcalinas por la adición de sulfato de cobre; Su intensidad depende solamente del número de enlaces peptídicos por gramo, que es similar en todas las proteínas.
Propiedades fisicoquímicas de las proteínas
El peso molecular de las proteínas
El peso molecular de las proteínas no puede determinarse por los métodos de la química clásica (por ejemplo, depresión del punto de congelación), porque requieren soluciones de una concentración de proteína más alta que la que se puede preparar.
Si una proteína contiene sólo una molécula de uno de los aminoácidos o un átomo de hierro, cobre u otro elemento, se puede calcular el peso molecular mínimo de la proteína o una subunidad; Por ejemplo, la proteína mioglobina contiene 0,34 gramos de hierro en 100 gramos de proteína. El peso atómico del hierro es 56; Por lo tanto el peso molecular mínimo de la mioglobina es (56 x 100) / 0,34 = aproximadamente 16.500.
Las mediciones directas del peso molecular de la mioglobina producen el mismo valor. Sin embargo, el peso molecular de la hemoglobina, que también contiene 0,34% de hierro, se ha encontrado que es de 66.000 o 4 × 16.500; Así la hemoglobina contiene cuatro átomos de hierro.
El método más frecuentemente usado para determinar el peso molecular de las proteínas es la ultracentrifugación, es decir, el hilado en una centrífuga a velocidades de hasta aproximadamente 60.000 revoluciones por minuto. Fuerzas centrífugas de más de 200.000 veces la fuerza gravitacional sobre la superficie de la Tierra se alcanzan a tales velocidades.
Las primeras ultracentrífugas, construidas en 1920, se utilizaron para determinar el peso molecular de las proteínas. Se han determinado los pesos moleculares de un gran número de proteínas.
La mayorıa consiste en varias subunidades, cuyo peso molecular es usualmente inferior a 100.000 y con frecuencia oscila entre 20.000 y 30.000. Proteínas de pesos moleculares muy altos se encuentran entre las hemocininas, las proteínas respiratorias que contienen cobre de los invertebrados; Algunos oscilan entre varios millones. Aunque no hay un límite inferior definido para el peso molecular de las proteínas, las secuencias de aminoácidos cortas se denominan normalmente péptidos.
La forma de las moléculas de proteínas
En la técnica de difracción de rayos X, se permite que los rayos X golpeen un cristal de proteína. Los rayos X, difractados (doblados) por el cristal, inciden sobre una placa fotográfica, formando un patrón de manchas. Este método revela que las cadenas peptídicas pueden asumir formas muy complicadas, aparentemente irregulares. Dos extremos en forma incluyen la estructura estrechamente plegada de las proteínas globulares y la estructura unidimensional alargada de las proteínas fibrosas filiformes; Ambos fueron reconocidos muchos años antes de la técnica de difracción de rayos X se desarrolló.
Las soluciones de proteínas fibrosas son extremadamente viscosas (es decir, pegajosas); Las de las proteínas globulares tienen baja viscosidad (es decir, fluyen fácilmente).
Una solución al 5 por ciento de una proteína globular-ovoalbúmina, por ejemplo, fluye fácilmente a través de un tubo de vidrio estrecho; Una solución de gelatina al 5 por ciento, una proteína fibrosa, sin embargo, no fluye a través del tubo, porque es líquido sólo a altas temperaturas y se solidifica a temperatura ambiente. Incluso las soluciones que contienen sólo 1 o 2 por ciento de gelatina son altamente viscosas y fluyen a través de un tubo estrecho muy lentamente o sólo bajo presión.
Se puede imaginar que las cadenas peptídicas alargadas de las proteínas fibrosas se enredan no sólo mecánicamente sino también por atracción mutua de sus cadenas laterales, y de esta manera incorporan grandes cantidades de agua. Sin embargo, la mayoría de los grupos hidrófilos (atrayentes de agua) de las proteínas globulares se encuentran en la superficie de las moléculas y, como resultado, las proteínas globulares incorporan sólo unas pocas moléculas de agua.
Si una solución de una proteína fibrosa fluye a través de un tubo estrecho, las moléculas alargadas se orientan paralelamente a la dirección del flujo y la solución se convierte así en birrefringente como un cristal; Es decir, divide un rayo de luz en dos componentes que viajan a diferentes velocidades y están polarizados en ángulos rectos entre sí. Las proteínas globulares no muestran este fenómeno, que se llama birrefringencia de flujo.
Las soluciones de miosina, la proteína contráctil de los músculos, muestran una birrefringencia de flujo muy alto; Otras proteínas con birrefringencia de flujo muy elevado incluyen soluciones de fibrinógeno, el material de coagulación del plasma sanguíneo y soluciones de virus del mosaico del tabaco. Las gamma-globulinas del plasma sanguíneo muestran birrefringencia de bajo flujo y ninguna se puede observar en soluciones de albúmina sérica y ovoalbúmina.

Hidratación de proteínas
Cuando las proteínas secas están expuestas al aire de alto contenido de agua, rápidamente enlazan agua hasta una cantidad máxima, que difiere para diferentes proteínas; Por lo general es del 10 al 20 por ciento del peso de la proteína.
Los grupos hidrófilos de una proteína son principalmente los grupos cargados positivamente en las cadenas laterales de lisina y arginina y los grupos cargados negativamente de ácido aspártico y glutámico. La hidratación (es decir, la unión del agua) también puede ocurrir en los grupos hidroxilo (-OH) de serina y treonina o en los grupos amida (-CONH _ {2}) de asparagina y glutamina.
La unión de moléculas de agua a grupos cargados o polares (parcialmente cargados) se explica por la estructura dipolar de la molécula de agua; Es decir, los dos átomos de hidrógeno cargados positivamente forman un ángulo de aproximadamente 105º, con el átomo de oxígeno cargado negativamente en el ápice. El centro de las cargas positivas está situado entre los dos átomos de hidrógeno; El centro de la carga negativa del átomo de oxígeno está en el ápice del ángulo.
El polo negativo de la molécula de agua dipolar se une a grupos cargados positivamente; El polo positivo se une a los cargados negativamente. El polo negativo de la molécula de agua también se une a los grupos hidroxilo y amino de la proteína.
El agua de hidratación es esencial para la estructura de los cristales de proteínas; Cuando están completamente deshidratadas, la estructura cristalina se desintegra. En algunas proteínas este proceso va acompañado de desnaturalización y pérdida de la función biológica.
En las soluciones acuosas, las proteínas unen algunas de las moléculas de agua muy firmemente; Otras están ligadas muy flojamente o forman islas de moléculas de agua entre bucles de cadenas peptídicas dobladas. Debido a que las moléculas de agua en una isla como se piensa que se orientan como en el hielo, que es el agua cristalina, las islas de agua en las proteínas se llaman icebergs.
Las moléculas de agua también pueden formar puentes entre los grupos carbonilo e imino de cadenas peptídicas adyacentes, dando como resultado estructuras similares a las de la hoja plisada pero con una molécula de agua en la posición de los enlaces de hidrógeno de esa configuración. El grado de hidratación de las moléculas de proteína en soluciones acuosas es importante, porque algunos de los métodos usados para determinar el peso molecular de las proteínas producen el peso molecular de la proteína hidratada.
La cantidad de agua unida a un gramo de una proteína globular en solución varía de 0,2 a 0,5 gramos. Muchas cantidades mayores de agua se inmovilizan mecánicamente entre las cadenas peptídicas alargadas de proteínas fibrosas; Por ejemplo, un gramo de gelatina puede inmovilizar a temperatura ambiente 25 a 30 gramos de agua.
La hidratación de las proteínas es necesaria para su solubilidad en agua. Si el agua de hidratación de una proteína disuelta en agua se reduce mediante la adición de una sal tal como sulfato de amonio, la proteína ya no es soluble y se salga o precipita. El proceso de salado es reversible porque la proteína no está desnaturalizada (es decir, irreversiblemente convertida en un material insoluble) mediante la adición de sales tales como cloruro de sodio, sulfato de sodio o sulfato de amonio.
Algunas globulinas, llamadas euglobulinas, son insolubles en agua en ausencia de sales; Su insolubilidad se atribuye a la mutua interacción de los grupos polares en la superficie de las moléculas adyacentes, un proceso que da lugar a la formación de grandes agregados de moléculas. La adición de pequeñas cantidades de sal hace que las euglobulinas se vuelvan solubles.
Este proceso, denominado salting in, resulta de una combinación entre aniones (iones cargados negativamente) y cationes (iones cargados positivamente) de la sal y cargas positivas y negativamente cargadas de las euglobulinas. La combinación evita la agregación de moléculas de euglobulina evitando la formación de puentes salinos entre ellos. La adición de más sulfato de sodio o amonio hace que las euglobulinas salgan nuevamente y precipiten.
Electroquímica de proteínas
Debido a que el grupo α-amino y el grupo α-carboxilo de los aminoácidos se convierten en enlaces peptídicos en la molécula de proteína, sólo hay un grupo α-amino (en el extremo N) y un grupo α-carboxilo (en el extremo C) En una molécula de proteína dada.
El carácter electroquímico de una proteína se ve muy poco afectado por estos dos grupos. De importancia, sin embargo, son los numerosos grupos de amonio cargados positivamente (-NH3 +) de lisina y arginina y los grupos carboxilo cargados negativamente (-COO-) de ácido aspártico y ácido glutámico. En la mayoría de las proteínas, el número de grupos cargados positivamente y negativamente varía de 10 a 20 por 100 aminoácidos.
- Valoración electrométrica
Cuando se añaden volúmenes medidos de ácido clorhídrico a una solución de proteína en agua libre de sal, el pH disminuye en proporción a la cantidad de iones de hidrógeno añadidos hasta que es aproximadamente 4. La adición adicional de ácido causa disminución mucho menor del pH debido a que la proteína Actúa como un tampón a valores de pH de 3 a 4. La reacción que tiene lugar en este intervalo de pH es la protonación del grupo carboxilo, es decir, la conversión de -COO- en -COOH.
La valoración electrométrica de una proteína isoeléctrica con hidróxido de potasio provoca un aumento muy lento del pH y una acción amortiguadora débil de la proteína a pH 7; Se produce una acción tampón muy fuerte en el intervalo de pH de 9 a 10.
La acción de amortiguación a pH 7, que es causada por la pérdida de protones (hidrógeno cargado positivamente) de los grupos imidazolio (es decir, la estructura de anillo de cinco miembros en el lado Cadena) de histidina, es débil porque el contenido de histidina de las proteínas es generalmente bajo.
La acción de tamponamiento mucho más fuerte a valores de pH de 9 a 10 es causada por la pérdida de protones del grupo hidroxilo de tirosina y de los grupos amonio de lisina. Finalmente, se pierden protones de los grupos guanidinio (es decir, la porción terminal que contiene nitrógeno de las cadenas laterales de arginina) de arginina a pH 12. Las titulaciones electrométricas de proteínas producen curvas similares. La valoración electrométrica hace posible la determinación del número aproximado de grupos carboxilo, grupos amonio, histidinas y tirosinas por molécula de proteína.
- Electroforesis
Las cadenas laterales positivas y negativamente cargadas de las proteínas hacen que se comporten como aminoácidos en un campo eléctrico; Es decir, migran durante la electroforesis a valores de pH bajos al cátodo (terminal negativo) ya valores de pH elevados para el ánodo (terminal positivo).
El punto isoeléctrico, el valor de pH al que la molécula de proteína no migra, está en el intervalo de pH 5 a 7 para muchas proteínas. Sin embargo, las proteínas como lisozima, citocromo c, histona y otras ricas en lisina y arginina tienen puntos isoeléctricos en el rango de pH entre 8 y 10. El punto isoeléctrico de la pepsina, que contiene muy pocos aminoácidos básicos, es cercano a 1 .
Conformación de proteínas globulares
Resultados de los estudios de difracción de rayos X
La mayoría de los conocimientos sobre la estructura secundaria y terciaria de las proteínas globulares se ha obtenido mediante el examen de sus cristales mediante difracción de rayos X. En esta técnica, los rayos X se permiten golpear el cristal; Los rayos X son difractados por el cristal e inciden sobre una placa fotográfica, formando un patrón de manchas.
La intensidad medida del patrón de difracción, según se registra en una película fotográfica, depende particularmente de la densidad electrónica de los átomos en el cristal de proteína.
Esta densidad es más baja en átomos de hidrógeno, y no dan un patrón de difracción visible. Aunque los átomos de carbono, oxígeno y nitrógeno producen patrones de difracción visibles, están presentes en un número tan grande -alrededor de 700 u 800 por 100 aminoácidos- que la resolución de la estructura de una proteína que contiene más de 100 aminoácidos es casi imposible.
La resolución se mejora considerablemente sustituyendo en las cadenas laterales de ciertos aminoácidos átomos muy pesados, particularmente los de metales pesados. Los iones de mercurio, por ejemplo, se unen a los grupos sulfhidrilo (-SH) de cisteína. El cloruro de platino se ha utilizado en otras proteínas. En las proteínas que contienen hierro, el átomo de hierro que ya está en la molécula es adecuado.
Aunque la técnica de difracción de rayos X no puede resolver la conformación tridimensional completa (es decir, la estructura secundaria y terciaria de la cadena peptídica), se ha obtenido una resolución completa por combinación de los resultados de la difracción de rayos X con los de aminoácidos Análisis de secuencias. De esta manera se ha resuelto la conformación completa de proteínas tales como mioglobina, quimotripsinógeno, lisozima y ribonucleasa.
El método de difracción de rayos X ha revelado arreglos estructurales regulares en proteínas; Una es una forma extendida de cadenas peptídicas antiparalelas que están unidas entre sí por enlaces de hidrógeno entre los grupos carbonilo e imino. Esta conformación, denominada hoja plisada, o estructura β, se encuentra en algunas proteínas fibrosas. También se han detectado hebras cortas de la estructura β en algunas proteínas globulares.
Una segunda disposición estructural importante es la α-hélice; Está formada por una secuencia de aminoácidos enrollados alrededor de un eje recto en una espiral derecha o una zurda. Cada vuelta de la hélice corresponde a una distancia de 5,4 angstroms (= 0,54 nanómetros) en la dirección del eje del tornillo y contiene 3,7 aminoácidos.
Por lo tanto, la longitud de la hélice \ alpha por residuo de aminoácido es 5,4 dividida por 3,7, o 1,5 angstroms (1 angstrom = 0,1 nanómetro). La estabilidad de la hélice α se mantiene mediante enlaces de hidrógeno entre los grupos carbonilo e imino de las vueltas vecinas de la hélice.
Se pensó que, a partir de los datos de los análisis de la molécula de mioglobina, más de la mitad de los cuales consta de hélices α, que la hélice α es el elemento estructural predominante de las proteínas globulares; Se sabe ahora que la mioglobina es excepcional a este respecto.
Las otras proteínas globulares para las que las estructuras han sido resueltas por difracción de rayos X contienen sólo pequeñas regiones de α-hélice. En la mayoría de ellos, las cadenas peptídicas se pliegan de manera aparentemente al azar, para lo cual se ha utilizado el término bobina aleatoria.
El término es engañoso, sin embargo, porque el plegamiento no es aleatorio; Más bien, está dictada por la estructura primaria y modificada por las estructuras secundarias y terciarias.

Las primeras proteínas para las que las estructuras internas estaban completamente resueltas son las proteínas que contienen hierro mioglobina y hemoglobina. La investigación de los cristales hidratados de estas proteínas por el bioquímico británico de origen australiano Max Perutz y el bioquímico británico John C. Kendrew, que ganó el Premio Nobel de Química de 1962 por su trabajo, reveló que el plegamiento de las cadenas peptídicas es tan estrecho que la mayoría Del agua se desplaza desde el centro de las moléculas globulares.
Se encontró que los aminoácidos que llevan los grupos amonio (-NH3 +) y carboxilo (-COO-) se desplazan a la superficie de las moléculas globulares y se encontró que los aminoácidos no polares se concentraban en el interior.
Otros enfoques para la determinación de la estructura proteica
Ninguno de los otros métodos físicos que se han utilizado para obtener información sobre la estructura secundaria y terciaria de las proteínas proporciona tanta información directa como la técnica de difracción de rayos X. La mayoría de las técnicas, sin embargo, son mucho más simples que la difracción de rayos X, lo que requiere, para la resolución de la estructura de una proteína, muchos años de trabajo y equipo, tales como computadoras electrónicas.
Algunas de las técnicas más simples se basan en las propiedades ópticas de las proteínas-refractividad, absorción de luz de diferentes longitudes de onda, rotación de la luz polarizada en el plano a diferentes longitudes de onda y luminiscencia.
Comportamiento espectrofotométrico
La espectrofotometría de soluciones proteicas (la medida del grado de absorbancia de luz por una proteína dentro de una longitud de onda especificada) es útil dentro del rango de luz visible sólo con proteínas que contienen grupos protésicos coloreados (los componentes no proteínicos).
Ejemplos de tales proteínas incluyen las proteínas hemáticas rojas de la sangre, los pigmentos púrpura de la retina del ojo, las proteínas verdes y amarillas que contienen pigmentos biliares, proteínas azules que contienen cobre y proteínas de color marrón oscuro llamadas melaninas.
Los enlaces peptídicos, debido a sus grupos carbonilo, absorben energía luminosa a longitudes de onda muy cortas (185-200 nanómetros). Sin embargo, los anillos aromáticos de fenilalanina, tirosina y triptófano absorben luz ultravioleta entre longitudes de onda de 280 y 290 nanómetros.
La absorbancia de la luz ultravioleta por el triptófano es mayor, la de la tirosina es menor, y la de la fenilalanina es menor. Por lo tanto, si se conoce el contenido de tirosina o triptófano de la proteína, la concentración de la solución de proteína puede determinarse midiendo su absorbancia entre 280 y 290 nanómetros.
Actividad óptica
Se recordará que los aminoácidos, con excepción de la glicina, presentan actividad óptica (rotación del plano de luz polarizada, véase más arriba Propiedades fisicoquímicas de los aminoácidos). No es sorprendente, por tanto, que las proteínas también sean ópticamente activas. Usualmente son levógiros (es decir, giran el plano de polarización hacia la izquierda) cuando se usa luz polarizada de longitudes de onda en el rango visible.
Aunque la rotación específica (función de la concentración de una solución proteica y la distancia que recorre la luz en ella) de la mayoría de los aminoácidos varía de -30 ° a + 30 °, el aminoácido cistina tiene una rotación específica de aproximadamente - 300 °. Aunque la rotación óptica de una proteína depende de todos los aminoácidos de los que se compone, los más importantes son la cistina y los aminoácidos aromáticos fenilalanina, tirosina y triptófano. La contribución de los otros aminoácidos a la actividad óptica de una proteína es insignificantemente pequeña.
Reactividad química de las proteínas
La información sobre la estructura interna de las proteínas puede obtenerse con métodos químicos que revelan si ciertos grupos están presentes en la superficie de la molécula proteica y, por tanto, pueden reaccionar o si están enterrados dentro de las cadenas peptídicas estrechamente dobladas y, por tanto, son incapaces de reaccionar. Los reactivos químicos utilizados en tales investigaciones deben ser ligeros que no afectan la estructura de la proteína.
La reactividad de la tirosina es de especial interés. Se ha encontrado, por ejemplo, que sólo tres de las seis tirosinas encontradas en la enzima ribonucleasa natural pueden ser yodadas (es decir, reaccionadas para aceptar un átomo de yodo). La descomposición catalizada por enzima de ribonucleasa yodada se utiliza para identificar los péptidos en los que están presentes las tirosinas yodadas.
Las tres tirosinas que pueden ser yodadas se encuentran en la superficie de la ribonucleasa; Los otros, asumidos como inaccesibles, se dice que están enterrados en la molécula. La tirosina también se puede identificar usando otras técnicas, por ejemplo, tratamiento con compuestos de diazonio o tetranitrometano. Debido a que los compuestos formados están coloreados, pueden detectarse fácilmente cuando la proteína se descompone con enzimas.
La cisteína puede detectarse por acoplamiento con compuestos tales como ácido yodoacético o yodoacetamida; La reacción da como resultado la formación de carboximetilcisteína o carbamidometilcisteína, que puede detectarse mediante la determinación de aminoácidos de los péptidos que los contienen.
Los grupos imidazol de ciertas histidinas también se pueden localizar por acoplamiento con los mismos reactivos bajo diferentes condiciones. Desafortunadamente, pocos otros aminoácidos pueden marcarse sin cambios en la estructura secundaria y terciaria de la proteína.
Asociación de subunidades proteicas
Muchas proteínas con pesos moleculares de más de 50.000 ocurren en soluciones acuosas como complejos: dímeros, tetrámeros y polímeros superiores, es decir, como cadenas de dos, cuatro o más unidades estructurales básicas que se repiten. Las subunidades, que se llaman monómeros o protómeros, por lo general están presentes como un número par. Se ha encontrado que menos del 10 por ciento de los polímeros tienen un número impar de monómeros.
Se cree que la disposición de las subunidades es regular y puede ser cíclica, cúbica o tetraédrica. Algunas de las proteínas pequeñas también contienen subunidades. La insulina, por ejemplo, con un peso molecular de aproximadamente 6.000, consiste en dos cadenas peptídicas unidas entre sí por puentes disulfuro (-S-S-).
Se han encontrado enlaces disulfuro intercatenarios similares en las inmunoglobulinas. En otras proteínas, los enlaces de hidrógeno y los enlaces hidrófobos (resultantes de la interacción entre las cadenas laterales de aminoácidos de valina, leucina, isoleucina y fenilalanina) provocan la formación de agregados de las subunidades. Las subunidades de algunas proteínas son idénticas; Las de los demás difieren. La hemoglobina es un tetrámero que consta de dos cadenas α y dos cadenas β.
Desnaturalización de proteínas
Cuando se hierve una solución de una proteína, la proteína se vuelve a menudo insoluble, es decir, se desnaturaliza y permanece insoluble incluso cuando la solución se enfría. La desnaturalización de las proteínas de la clara de huevo por calor -como al hervir un huevo- es un ejemplo de desnaturalización irreversible.
La proteína desnaturalizada tiene la misma estructura primaria que la proteína original, o nativa. Sin embargo, las fuerzas débiles entre grupos cargados y las fuerzas débiles de atracción mutua de grupos no polares se interrumpen a temperaturas elevadas; Como resultado, se pierde la estructura terciaria de la proteína. En algunos casos, la estructura original de la proteína puede regenerarse; El proceso se llama renaturalización.
La desnaturalización puede producirse de varias maneras. Las proteínas se desnaturalizan por tratamiento con agentes alcalinos o ácidos, oxidantes o reductores, y ciertos disolventes orgánicos. Interesante entre los agentes desnaturalizantes son aquellos que afectan a la estructura secundaria y terciaria sin afectar a la estructura primaria. Los agentes más frecuentemente utilizados para este fin son la urea y el cloruro de guanidinio.
Estas moléculas, debido a su alta afinidad por los enlaces peptídicos, rompen los enlaces de hidrógeno y los puentes de sal entre las cadenas laterales positivas y negativas, con lo que se suprime la estructura terciaria de la cadena peptídica. Cuando los agentes desnaturalizantes se eliminan de una solución de proteína, la proteína nativa se vuelve a formar en muchos casos.
La desnaturalización también se puede lograr mediante la reducción de los enlaces disulfuro de cistina, es decir, la conversión del enlace disulfuro (-S-S-) en dos grupos sulfhidrilo (-SH).
Esto, por supuesto, da lugar a la formación de dos cisteínas. La reoxidación de las cisteínas por exposición al aire a veces regenera la proteína nativa. En otros casos, sin embargo, las cisteínas equivocadas se unen entre sí, dando como resultado una proteína diferente. Finalmente, la desnaturalización también se puede lograr exponiendo proteínas a disolventes orgánicos tales como etanol o acetona. Se cree que los disolventes orgánicos interfieren con la atracción mutua de grupos no polares.
Algunas de las proteínas más pequeñas, sin embargo, son extremadamente estables, incluso contra el calor; Por ejemplo, las soluciones de ribonucleasa pueden ser expuestas durante cortos periodos de tiempo a temperaturas de 90 ° C (194 ° F) sin experimentar una desnaturalización significativa. La desnaturalización no implica cambios idénticos en las moléculas de proteínas. Sin embargo, una propiedad común de proteínas desnaturalizadas es la pérdida de actividad biológica, por ejemplo, la capacidad de actuar como enzimas u hormonas.
Aunque la desnaturalización se ha considerado durante mucho tiempo como una reacción de todo o nada, ahora se cree que existen muchos estados intermedios entre proteínas nativas y desnaturalizadas. En algunos casos, sin embargo, la ruptura de un enlace clave podría ser seguida por la descomposición completa de la conformación de la proteína nativa.
Aunque muchas proteínas nativas son resistentes a la acción de la enzima tripsina, que descompone las proteínas durante la digestión, son hidrolizadas por la misma enzima después de la desnaturalización. Los enlaces peptídicos que pueden ser divididos por tripsina son inaccesibles en las proteínas nativas pero se hacen accesibles durante la desnaturalización.
De manera similar, las proteínas desnaturalizadas dan reacciones de color más intensas para la tirosina, la histidina y la arginina que las mismas proteínas en el estado nativo. La mayor accesibilidad de los grupos reactivos de proteínas desnaturalizadas se atribuye a un despliegue de las cadenas peptídicas.
Si la desnaturalización se puede realizar fácilmente y si la renaturalización es difícil, ¿cómo se mantiene la conformación nativa de proteínas globulares en organismos vivos, en la que se producen por etapas, mediante la incorporación de un aminoácido a la vez? Los experimentos sobre la biosíntesis de proteínas a partir de aminoácidos que contienen carbono radiactivo o hidrógeno pesado revelan que la molécula de proteína crece escalonadamente desde el extremo N hasta el extremo C; En cada paso se incorpora un único residuo de aminoácido.
Tan pronto como la cadena peptídica en crecimiento contiene seis o siete residuos de aminoácidos, las cadenas laterales interaccionan entre sí y, por tanto, provocan desviaciones de la configuración recta o de la cadena β.
Dependiendo de la naturaleza de las cadenas laterales, esto puede dar como resultado la formación de una hélice α o de bucles cerrados por enlaces de hidrógeno o puentes disulfuro. La conformación final es probablemente congelada cuando la cadena peptídica alcanza una longitud de 50 o más residuos de aminoácidos.
Clasificación de las proteínas
Para informarte acerca de cómo se clasifican las proteínas según su solubilidad y sus funciones biológicas, te invito a que leas la información que te dejo en este enlace.
Referencia:
https://www.britannica.com/science/protein