Clasificación de las proteínas de acuerdo a su solubilidad y funciones biológicas según sus propiedades químicas y físicas. Estructura especial y función de las Proteínas. Características generales de las proteínas a nivel bioquímico y fisiológico.
Clasificación de las proteínas por su solubilidad
Después de que dos químicos alemanes, Emil Fischer y Franz Hofmeister, declararan de forma independiente en 1902 que las proteínas son esencialmente polipéptidos que consisten en muchos aminoácidos, se intentó clasificar las proteínas según sus propiedades químicas y físicas, porque la función biológica de las proteínas aún no se había establecido. (El carácter proteico de las enzimas no se demostró hasta la década de 1920).
Las Proteínas se clasificaron principalmente de acuerdo a su solubilidad en una serie de disolventes. Sin embargo, Esta clasificación ya no es satisfactoria porque las proteínas de estructura y función muy diferentes a veces tienen solubilidades similares; Por el contrario, las proteínas de la misma función y estructura similar a veces tienen diferentes solubilidades. Los términos asociados con la clasificación antigua, sin embargo, siguen siendo ampliamente utilizados. Se definen a continuación.
Las albúminas son proteínas que son solubles en agua y en agua semi-saturada con sulfato de amonio. Por otra parte, las globulinas son saladas (es decir, precipitadas) por medio de la saturación con sulfato de amonio.
Las globulinas que son solubles en agua libre de sal se llaman pseudoglobulinas; Aquellos insolubles en agua libre de sal son euglobulinas. Tanto las prolaminas como las glutelinas, que son proteínas vegetales, son insolubles en agua; Las prolaminas se disuelven en 50 a 80 por ciento de etanol, las glutelinas en solución acidificada o alcalina.
El término protamina se utiliza para un número de proteínas en espermatozoides de peces que consisten en aproximadamente 80 por ciento de arginina y por lo tanto son fuertemente alcalinas. Las histonas, que son menos alcalinas, aparentemente sólo se producen en los núcleos celulares, donde están unidos a ácidos nucleicos.
El término escleroproteínas se ha utilizado para las proteínas insolubles de los órganos animales. Incluyen la queratina, la proteína insoluble de ciertos tejidos epiteliales, como la piel o el cabello, y el colágeno, la proteína del tejido conectivo.

Un gran grupo de proteínas se ha denominado proteínas conjugadas, porque son moléculas complejas de proteínas que consisten en restos proteicos y no proteínicos. La porción no proteica se denomina grupo prostético.
Las proteínas conjugadas pueden subdividirse en mucoproteínas, que, además de proteínas, contienen carbohidratos; Lipoproteínas, que contienen lípidos; Fosfoproteínas, que son ricas en fosfato; Cromoproteínas, que contienen pigmentos tales como hierro-porfirinas, carotenoides, pigmentos biliares y melanina; Y finalmente, nucleoproteínas, que contienen ácido nucleico.
La debilidad de la clasificación anterior reside en el hecho de que muchas, si no todas, las globulinas contienen pequeñas cantidades de carbohidratos; Por lo tanto no hay frontera aguda entre las globulinas y las mucoproteínas.
Además, las fosfoproteínas no tienen un grupo prostético que pueda ser aislado; Son meramente proteínas en las que algunos de los grupos hidroxilo de la serina están fosforilados (es decir, contienen fosfato). Finalmente, las globulinas incluyen proteínas con funciones muy diferentes: enzimas, anticuerpos, proteínas fibrosas y proteínas contráctiles.
Clasificación de las proteínas de acuerdo a sus funciones biológicas
En vista del estado insatisfactorio de la antigua clasificación, es preferible clasificar las proteínas según su función biológica. Tal clasificación está lejos de ser ideal, sin embargo, porque una proteína puede tener más de una función.
La proteína micosina contráctil, por ejemplo, también actúa como una ATPasa (adenosina trifosfatasa), una enzima que hidroliza el trifosfato de adenosina (elimina un grupo fosfato del ATP introduciendo una molécula de agua). Otro problema con la clasificación funcional es que la función definida de una proteína con frecuencia no se conoce.
Una proteína no puede ser llamada una enzima mientras su sustrato (el compuesto específico sobre el cual actúa) no se conoce. Ni siquiera se puede probar su acción enzimática cuando su sustrato no se conoce.
Estructura Especial Y Función De Las Proteínas
A pesar de sus debilidades, se utiliza aquí una clasificación funcional para demostrar, siempre que sea posible, la correlación entre la estructura y la función de una proteína. Las proteínas estructurales fibrosas se presentan primero, porque su estructura es más simple que la de las proteínas globulares y más claramente relacionada con su función, que es el mantenimiento de una estructura rígida o una flexible.
Proteínas estructurales
Escleroproteínas
1. Colágeno
El colágeno es la proteína estructural de los huesos, tendones, ligamentos y piel. Durante muchos años se consideró que el colágeno era insoluble en agua. Sin embargo, parte del colágeno de la piel de la ternera puede extraerse con tampón citrato a pH 3.7. Un precursor de colágeno llamado procollagen se convierte en el cuerpo en colágeno.
El Procollagen tiene un peso molecular de 120.000. La escisión de uno o unos pocos enlaces peptídicos de procolágeno produce colágeno, que tiene tres subunidades, cada una con un peso molecular de 95.000; Por lo tanto, el peso molecular del colágeno es 285.000 (3 × 95.000).
Las tres subunidades están enrolladas en forma de espirales alrededor de un eje recto alargado. La longitud de cada subunidad es de 2.900 angstroms, y su diámetro es de aproximadamente 15 angstroms. Las tres cadenas están escalonadas, de modo que el trímero no tiene límites terminales definidos.
El colágeno difiere de todas las demás proteínas en su alto contenido de prolina e hidroxiprolina. La hidroxiprolina no se produce en cantidades significativas en ninguna otra proteína excepto la elastina. La mayor parte de la prolina en colágeno está presente en la secuencia glicina-prolina-X, en la que X es con frecuencia alanina o hidroxiprolina.
El colágeno no contiene cistina o triptófano y por lo tanto no puede sustituir a otras proteínas en la dieta. La presencia de prolina provoca torceduras en la cadena peptídica y, por tanto, reduce la longitud de la unidad de aminoácidos desde 3,7 angstroms en la cadena extendida de la estructura β a 2,86 angstroms en la cadena de colágeno. En la triple hélice entrelazada, las glicinas están dentro, cerca del eje; Las prolinas están fuera.
El colágeno nativo resiste la acción de la tripsina pero es hidrolizado por la enzima bacteriana colagenasa. Cuando el colágeno se hierve con agua, la triple hélice se destruye, y las subunidades se hidrolizan parcialmente; El producto es gelatina. Las cadenas peptídicas desplegadas de gelatina atrapan grandes cantidades de agua, dando como resultado una molécula hidratada.
Cuando el colágeno se trata con ácido tánico o con sales de cromo, se forman enlaces entre las fibras de colágeno, y se vuelve insoluble; La conversión de piel en cuero se basa en este proceso de bronceado. El material bronceado es insoluble en agua caliente y no puede convertirse en gelatina.
Sin embargo, tras la exposición al agua entre 62 ° y 63 ° C (144 ° a 145 ° F), los enlaces cruzados formados por los curtientes se derrumban y el cuero se contrae irreversiblemente hasta aproximadamente un tercio de su volumen original.
El colágeno parece experimentar un proceso de envejecimiento en los organismos vivos que puede ser causado por la formación de enlaces cruzados entre las fibras de colágeno. Se forman mediante la conversión de algunas cadenas laterales de lisina en aldehídos (compuestos con la estructura general RCHO), y la combinación de los aldehídos con los grupos ε-amino de cadenas laterales de lisina intactas.
La proteína elastina, que se produce en las fibras elásticas del tejido conectivo, contiene enlaces cruzados similares y puede resultar de la combinación de fibras de colágeno con otras proteínas. Cuando el colágeno reticulado o la elastina se degrada, se forman productos de los fragmentos de lisina reticulados, denominados desmosinas e isodesmosinas.
2. Queratina
La queratina, la proteína estructural de las células epiteliales en las capas más externas de la piel, ha sido aislada de pelo, uñas, pezuñas y plumas. La queratina es completamente insoluble en agua fría o caliente; No es atacado por enzimas proteolíticas (es decir, enzimas que se separan, o lisan, moléculas de proteína), y por lo tanto no pueden reemplazar proteínas en la dieta. La gran estabilidad de la queratina resulta de los numerosos enlaces disulfuro de la cistina.
La composición de aminoácidos de la queratina difiere de la del colágeno. Cistina puede representar el 24 por ciento de los aminoácidos totales. Las cadenas peptídicas de queratina están dispuestas en cantidades aproximadamente iguales de hojas plisadas antiparalelas y paralelas, en las que las cadenas peptídicas están unidas entre sí por enlaces de hidrógeno entre los grupos carbonilo e imino.
La reducción de los enlaces disulfuro a grupos sulfhidrilo da como resultado la disociación de las cadenas peptídicas, cuyo peso molecular es de 25.000 a 28.000 cada uno.
La formación de ondas permanentes en el tratamiento de belleza del cabello se basa en la reducción parcial de los enlaces disulfuro de la queratina capilar por tioglicol o algún otro agente reductor suave y posterior oxidación de los grupos sulfhidrilo (-SH) en el cabello reorientado a disulfuro (-S-S-) por exposición al oxígeno del aire.
La longitud de las fibras queratínicas depende de su contenido de agua. Pueden unir aproximadamente el 16 por ciento de agua; Esta hidratación va acompañada por un aumento en la longitud de las fibras de 10 a 12 por ciento.
La queratina más investigada es la queratina capilar, particularmente la de lana. Se compone de una mezcla de péptidos con alto y bajo contenido de cistina. Cuando la lana se calienta en agua a aproximadamente 90 ° C (190 ° F), se encoge irreversiblemente. Esto se atribuye a la rotura de enlaces de hidrógeno y otros enlaces no covalentes; Los enlaces disulfuro no parecen estar afectados.
3. Otras proteínas
La escleroproteína más investigada ha sido la fibroína, el material insoluble de la seda. La seda cruda que comprende el capullo del gusano de seda consta de dos proteínas. Uno, la sericina, es soluble en agua caliente; El otro, la fibroína, no lo es. La composición de aminoácidos de este último difiere de la de todas las demás proteínas. Contiene grandes cantidades de glicina, alanina, tirosina y serina; Pequeñas cantidades de los otros aminoácidos; Y no contienen azufre.
Las cadenas peptídicas están dispuestas en estructuras β antiparalelas. El fibroın es parcialmente soluble en soluciones concentradas de tiocianato de litio o en mezclas de sales cúpricas y etilendiamina. Tales soluciones contienen una proteína de peso molecular 170.000, que es un dímero de dos subunidades.
Poco se sabe sobre las escleroproteínas de las esponjas marinas o las proteínas insolubles de las membranas celulares de las células animales. Algunas de las membranas son solubles en detergentes; Otros, sin embargo, son detergentes insolubles.
Proteínas musculares
La cantidad total de proteínas musculares en mamíferos, incluyendo humanos, excede la de cualquier otra proteína. Alrededor del 40 por ciento del peso corporal de un adulto humano sano que pesa alrededor de 70 kilogramos (150 libras) es el músculo, que se compone de alrededor del 20 por ciento de proteína muscular. Por lo tanto, el cuerpo humano contiene alrededor de 5 a 6 kilogramos (11 a 13 libras) de proteína muscular.
Una fracción parecida a la albúmina de estas proteínas, originalmente llamada miógeno, contiene varias enzimas-fosforilasa, aldolasa, fosfato deshidrogenasa de gliceraldehído y otras; No parece estar involucrado en la contracción.
La fracción de globulina contiene miosina, la proteína contráctil, que también ocurre en las plaquetas de la sangre, pequeños cuerpos encontrados en la sangre. Sustancias contráctiles similares ocurren en otras estructuras contráctiles; Por ejemplo, en los cilios o flagelos (órganos de locomoción parecidos a los haces) de bacterias y protozoos. En contraste con las escleroproteínas, las proteínas contráctiles son solubles en soluciones salinas y susceptibles a la digestión enzimática.
La energía requerida para la contracción muscular es proporcionada por la oxidación de carbohidratos o lípidos. El término reacción mecanicoquímica se ha utilizado para esta conversión de la sustancia química en energía mecánica. Se sabe que el proceso molecular subyacente a la reacción implica las proteínas del músculo fibroso, cuyas cadenas peptídicas sufren un cambio de conformación durante la contracción.
La miosina, que puede extraerse del músculo fresco añadiéndolo a una solución enfriada de cloruro de potasio diluido y bicarbonato sódico, es insoluble en agua.
La miosina, cuyas soluciones son altamente viscosas, consiste en una cadena peptídica alargada, probablemente de cadena doble, que está enrollada en ambos extremos de tal manera que se forma un glóbulo terminal. La longitud de la molécula es de aproximadamente 160 nanómetros y su diámetro medio de 2,6 nanómetros.
El peso equivalente de cada uno de los dos glóbulos terminales es de aproximadamente 30.000; El peso molecular de la miosina es cercano a 500.000. La tripsina divide la miosina en grandes fragmentos llamados meromiosina. La miosina contiene muchos aminoácidos con cadenas laterales positivas y cargadas negativamente; Forman 18 y 16 por ciento, respectivamente, del número total de aminoácidos.
La miosina cataliza la escisión hidrolítica de ATP (adenosina trifosfato). Una proteína más pequeña con propiedades similares a las de la miosina es la tropomiosina. Tiene un peso molecular de 70.000 y dimensiones de 45 por 2 nanómetros. Más del 90 por ciento de sus cadenas peptídicas están presentes en la forma de \ alpha - hélice.
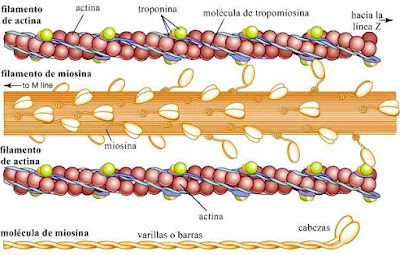
La miosina se combina fácilmente con otra proteína muscular llamada actina, cuyo peso molecular es de aproximadamente 50.000; Forma 12 a 15 por ciento de las proteínas musculares. La actina puede existir en dos formas: una, G-actina, es globular; La otra, F-actina, es fibrosa. La actomiosina es una molécula compleja formada por una molécula de miosina y una o dos moléculas de actina. En el músculo, los filamentos de actina y miosina están orientados paralelos entre sí y al eje largo del músculo.
Los filamentos de actina están unidos entre sí longitudinalmente por hilos finos llamados filamentos S. Durante la contracción, los filamentos S se acortan, de modo que los filamentos de actina se deslizan uno hacia el otro, pasando los filamentos de miosina, causando así un acortamiento del músculo (para una descripción detallada del proceso, véase músculo: músculo estriado).
Fibrinógeno y fibrina
El fibrinógeno, la proteína del plasma sanguíneo, se convierte en la proteína fibrina insoluble durante el proceso de coagulación. El fluido libre de fibrinógeno obtenido después de la eliminación del coágulo, llamado suero sanguíneo, es plasma sanguíneo menos fibrinógeno. El contenido de fibrinógeno en el plasma sanguíneo es de 0,2 a 0,4 por ciento.

El fibrinógeno puede precipitarse del plasma sanguíneo por medio de la saturación con cloruro sódico. Las soluciones de fibrinógeno son altamente viscosas y muestran una fuerte birrefringencia de flujo.
En micrografías electrónicas las moléculas aparecen como varillas con una longitud de 47,5 nanómetros y un diámetro de 1,5 nanómetros; Además, dos terminales y un nódulo central son visibles. El peso molecular es 340.000. Un porcentaje inusualmente alto, aproximadamente el 36 por ciento, de las cadenas laterales de aminoácidos está cargado positivamente o negativamente.
El proceso de coagulación es iniciado por la enzima trombina, que cataliza la rotura de unos pocos enlaces peptídicos de fibrinógeno; Como resultado, se liberan dos pequeños fibrinopéptidos con pesos moleculares de 1.900 y 2.400. El resto de la molécula de fibrinógeno, un monómero, es soluble y estable a valores de pH inferiores a 6 (es decir, en soluciones ácidas). En solución neutra (pH 7) el monómero se convierte en una molécula más grande, fibrina insoluble; Esto resulta de la formación de nuevos enlaces peptídicos.
Los enlaces peptídicos recién formados forman enlaces cruzados intermoleculares e intramoleculares, dando lugar así a un gran coágulo, en el que todas las moléculas están unidas entre sí. La coagulación, que tiene lugar sólo en presencia de iones calcio, puede evitarse por compuestos tales como oxalato o citrato, que tienen una alta afinidad por los iones calcio.
Albuminas, globulinas y otras proteínas solubles
El plasma sanguíneo, la linfa y otros fluidos animales contienen generalmente de uno a siete gramos de proteína por cada 100 mililitros de líquido, que incluye pequeñas cantidades de cientos de enzimas y un gran número de hormonas proteicas. La discusión que sigue está limitada en gran medida a las proteínas que se producen en grandes cantidades y pueden aislarse fácilmente de los fluidos corporales.
El suero sanguíneo humano contiene aproximadamente 7 por ciento de proteína, dos tercios de los cuales están en la fracción de albúmina; El otro tercio está en la fracción de globulina. La electroforesis del suero revela un gran pico de albúmina y tres picos de globulina más pequeños, las globulinas alfa, beta y gamma. Las cantidades de alfa-, beta- y gamma-globulina en suero humano normal son aproximadamente 1,5, 1,9 y 1,1 por ciento, respectivamente.
Cada fracción de globulina es una mezcla de muchas proteínas diferentes, como se ha demostrado por inmunoelectroforesis. En este método, el suero de un animal (por ejemplo, un conejo) inyectado con suero humano se deja difundir en las cuatro bandas de proteína - albúmina, alfa, beta y gamma globulina - obtenidas de la electroforesis de suero humano.
Debido a que el animal ha sido previamente inyectado con suero humano, su sangre contiene anticuerpos (sustancias formadas en respuesta a una sustancia extraña introducida en el cuerpo) contra cada una de las proteínas del suero humano; Cada anticuerpo se combina con la proteína sérica (antígeno) que causó su formación en el animal.
El resultado es la formación de aproximadamente 20 regiones de precipitado insoluble de antígeno-anticuerpo, que aparecen como arcos blancos en el gel transparente del medio de electroforesis. Cada región corresponde a una proteína de suero humano diferente.
Proteínas del suero sanguíneo
La albúmina sérica es mucho menos heterogénea (es decir, contiene menos proteínas distintas) que las globulinas; De hecho, es una de las pocas proteínas séricas que se pueden obtener en forma cristalina. La albúmina sérica se combina fácilmente con muchos colorantes ácidos (por ejemplo, rojo Congo y naranja metilo); Con bilirrubina, el pigmento amarillo de la bilis; Y con ácidos grasos. Parece actuar, en los organismos vivos, como portador de ciertas sustancias biológicas.
Presente en suero sanguíneo en concentración relativamente alta, la albúmina sérica también actúa como un coloide protector, una proteína que estabiliza otras proteínas. La albúmina (peso molecular de 68.000) tiene un solo grupo sulfhidrilo libre (-SH), que en la oxidación forma un enlace disulfuro con el grupo sulfhidrilo de otra molécula de albúmina de suero, formando así un dímero. El punto isoeléctrico de la albúmina sérica es de pH 4,7.
La fracción alfa-globulina del suero sanguíneo es una mezcla de varias proteínas conjugadas. Las más conocidas son una α-lipoproteína (combinación de lípidos y proteínas) y dos mucoproteínas (combinaciones de carbohidratos y proteínas). Una mucoproteína se llama orosomucoide, o α1-glicoproteína ácida; El otro se llama haptoglobina porque se combina específicamente con la globina, el componente proteico de la hemoglobina.
La haptoglobina contiene aproximadamente 20 por ciento de carbohidratos. La fracción de beta-globulina del suero contiene, además de las lipoproteínas y mucoproteínas, dos proteínas de unión a los metales, la transferrina y la ceruloplasmina, que unen el hierro y el cobre, respectivamente. Son los principales portadores de hierro y cobre de la sangre.
Las gammaglobulinas son las globulinas más heterogéneas. Aunque la mayoría tienen un peso molecular de aproximadamente 150.000, el de algunos, llamados macroglobulinas, es tan alto como 800.000. Debido a que los anticuerpos típicos son del mismo tamaño y exhiben el mismo comportamiento electroforético que las gammaglobulinas, se denominan inmunoglobulinas. La designación IgM o gamma M (γM) se utiliza para las macroglobulinas; La denominación IgG o gamma G (γG) se utiliza para las gammaglobulinas de peso molecular 150.000.
Proteínas de la leche
La leche contiene lo siguiente: una albúmina, α-lactalbúmina; Una globulina, beta-lactoglobulina; Y una fosfoproteína, caseína. Si se agrega ácido a la leche, la caseína precipita. El líquido acuoso restante (la solución sobrenadante), o suero de leche, contiene α-lactoalbúmina y β-lactoglobulina. Ambos se han obtenido en forma cristalina; En la leche de vaca, sus pesos moleculares son aproximadamente 14.000 y 18.400, respectivamente.
La lactoglobulina también se presenta como un dímero de peso molecular 37.000. Las variaciones genéticas pueden producir pequeñas variaciones en la composición de aminoácidos de la lactoglobulina. La composición de aminoácidos y la estructura terciaria de la lactoalbúmina se asemejan a la de la lisozima, una proteína de huevo.
La caseína se precipita no sólo por la adición de ácido, sino también por la acción de la enzima renina, que se encuentra en el jugo gástrico. Rennin de los estómagos de ternera se utiliza para precipitar la caseína, de la que se hace el queso. La grasa láctea precipita con caseína; El azúcar de la leche, sin embargo, permanece en el sobrenadante (suero).
La caseína es una mezcla de varias fosfoproteínas similares, llamadas α-, β-, γ- y κ-caseína, todas las cuales contienen algunas cadenas laterales de serina combinadas con ácido fosfórico. Aproximadamente el 75 por ciento de caseína es α-caseína. La cistina se ha encontrado sólo en κ-caseína.
En la leche, la caseína parece formar glóbulos poliméricos (micelas) con monómeros dispuestos radialmente, cada uno con un peso molecular de 24.000; Las cadenas laterales ácidas ocurren predominantemente en la superficie de la micela, en vez de en el interior.
Proteínas de los huevos
Alrededor del 50 por ciento de las proteínas de la clara de huevo están compuestas de ovoalbúmina, que se obtiene fácilmente en cristales. Su peso molecular es de 46.000 y su composición de aminoácidos difiere de la de la albúmina sérica. Otras proteínas de la clara de huevo son conalbúmina, lisozima, ovoglobulina, ovomucoide y avidina.
La lisozima es una enzima que hidroliza los carbohidratos que se encuentran en las cápsulas que ciertas bacterias secretan alrededor de ellas mismas; Causa la lisis (desintegración) de las bacterias. El peso molecular de la lisozima es de 14.100. Su estructura tridimensional es similar a la α-lactalbúmina, que estimula la formación de lactosa por la enzima lactosa sintetasa. La lisozima también se ha encontrado en la orina de pacientes que sufren de leucemia, meningitis y enfermedad renal.
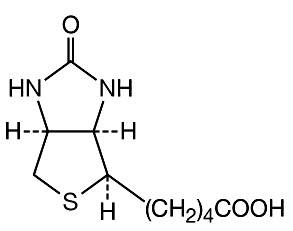
La avidina es una glicoproteína que combina específicamente con la biotina, una vitamina. En animales alimentados con grandes cantidades de clara de huevo cruda, la acción de la avidina da como resultado una "lesión de clara de huevo". El peso molecular de la avidina, que forma un tetrámero, es de 16.200. Su secuencia de aminoácidos es conocida.
Las proteínas de yema de huevo contienen una mezcla de lipoproteínas y livetins. Estos últimos son similares a la albúmina sérica, α-globulina y β-globulina. La yema también contiene una fosfoproteína, la fosvitina. La fosvitina, que también se ha encontrado en el esperma de los peces, tiene un peso molecular de 40.000 y una composición inusual de aminoácidos; Un tercio de sus aminoácidos son fosfoserina.
Protaminas e histonas
Las protaminas se encuentran en los espermatozoides de los peces. Las protaminas más investigadas son salminas de espermatozoides de salmón y clupeína de esperma de arenque. Las protaminas están unidas al ácido desoxirribonucleico (ADN), formando nucleoprotaminas. La composición de aminoácidos de las protaminas es simple; Contienen, además de grandes cantidades de arginina, pequeñas cantidades de cinco o seis otros aminoácidos.
La composición de la molécula de salmina, por ejemplo, es: Arg51, Ala4, Val4, Ile1, Pro7 y Ser6, en la que los números de subíndice indican el número de cada aminoácido en la molécula. Debido al alto contenido de arginina, los puntos isoeléctricos de las protaminas están a valores de pH de 11 a 12; Es decir, las protaminas son alcalinas. Los pesos moleculares de salmín y clupeína están cerca de 6.000. Todas las protaminas investigadas hasta ahora son mezclas de varias proteínas similares.
Las histonas son menos básicas que las protaminas. Contienen grandes cantidades de lisina o arginina y pequeñas cantidades de ácido aspártico y ácido glutámico. Las histonas ocurren en combinación con el ADN como nucleohistones en los núcleos de las células del cuerpo de animales y plantas, pero no en los espermatozoides de los animales.
Los pesos moleculares de las histonas varían de 10.000 a 22.000. En contraste con las protaminas, las histonas contienen la mayoría de los 20 aminoácidos, con la excepción del triptófano y los que contienen azufre. Al igual que las protaminas, las preparaciones de histonas son mezclas heterogéneas. Se ha determinado la secuencia de aminoácidos de algunas de las histonas.
Proteínas vegetales
Las proteínas vegetales, en su mayoría globulinas, se han obtenido principalmente a partir de las semillas ricas en proteínas de cereales y legumbres. Se encuentran pequeñas cantidades de albúminas en las semillas. Las globulinas más conocidas, insolubles en agua, se pueden extraer de las semillas mediante tratamiento con soluciones de cloruro de sodio del 2 al 10 por ciento.
Muchas globulinas vegetales se han obtenido en forma cristalina; Incluyen edestin de cáñamo, peso molecular 310.000; Amandina de almendras, 330.000; Concanavalina A (42.000) y B (96.000); Y canavalina (113.000) de habichuelas. Son polímeros de subunidades más pequeñas; Edestina, por ejemplo, es un hexámero de una subunidad con un peso molecular de 50.000 y concanavalina B un trímero de una subunidad con un peso molecular de 30.000.
Después de la extracción de lípidos de semillas de cereales por éter y alcohol, la extracción adicional con agua que contiene 50 a 80 por ciento de alcohol produce proteínas que son insolubles en agua pero solubles en mezclas agua-etanol y han sido llamados prolaminas. Su solubilidad en etanol acuoso puede resultar de su alto contenido de prolina y glutamina.
La gliadina, la prolamina del trigo, contiene 14 gramos de prolina y 46 gramos de ácido glutámico en 100 gramos de proteína; La mayor parte del ácido glutámico está en forma de glutamina.
Las cantidades totales de los aminoácidos básicos (arginina, lisina e histidina) en la gliadina son sólo el 5 por ciento del peso de la gliadina. Debido a que el contenido de glicina es bajo o inexistente, las poblaciones humanas dependientes del grano como única fuente de proteína sufren de deficiencia de lisina.
Proteínas conjugadas
Combinación de proteínas con grupos protésicos
El enlace entre una molécula de proteína y su grupo protésico es un enlace covalente (un enlace que comparte electrones) en las glicoproteínas, las biliproteínas y algunas de las proteínas heme.
En lipoproteínas, nucleoproteínas y algunas proteínas heme, los dos componentes están unidos por enlaces no covalentes; La unión se produce a partir de las mismas fuerzas que son responsables de la estructura terciaria de las proteínas: enlaces de hidrógeno, puentes salinos entre grupos cargados positivamente y negativamente, enlaces disulfuro e interacción mutua de grupos hidrofóbicos. En las metaloproteínas (proteínas con un elemento metálico como grupo prostético), el ión metálico forma habitualmente un centro al que se unen varios grupos.
Algunas de las proteínas conjugadas se han mencionado en las secciones anteriores porque se producen en el suero sanguíneo, en la leche y en los huevos; Otros se discuten a continuación en las secciones que se ocupan de las proteínas respiratorias y enzimas.
1. Mucoproteínas y glicoproteínas
Los grupos protésicos en las mucoproteínas y glicoproteínas son oligosacáridos (carbohidratos que consisten en un pequeño número de moléculas simples de azúcar) que normalmente contienen de cuatro a 12 moléculas de azúcar; Los azúcares más comunes son galactosa, manosa, glucosamina y galactosamina. La xilosa, la fucosa, el ácido glucurónico, el ácido siálico y otros azúcares simples a veces también ocurren.
Algunas mucoproteínas contienen 20 por ciento o más de carbohidratos, usualmente en varios oligosacáridos unidos a diferentes partes de la cadena peptídica. La designación de mucoproteína se utiliza para proteínas con más de 3 a 4 por ciento de carbohidratos; Si el contenido de hidratos de carbono es inferior al 3 por ciento, la proteína se denomina a veces una glicoproteína o simplemente una proteína.
Las mucoproteínas, proteínas altamente viscosas llamadas originalmente mucinas, se encuentran en la saliva, en el jugo gástrico y en otras secreciones animales. Las mucoproteínas se producen en grandes cantidades en el cartílago, el líquido sinovial (el fluido lubricante de las articulaciones y los tendones) y la clara de huevo.
La mucoproteína del cartílago está formada por la combinación de colágeno con ácido condroitinsulfúrico, que es un polímero de ácido glucurónico o idurónico y acetilhexosamina o acetilgalactosamina. Todavía no está claro si el condroitinsulfato está unido al colágeno por enlaces covalentes.
2. Lipoproteínas y proteolípidos
El enlace entre la proteína y la porción lipídica de las lipoproteínas y proteolípidos es no covalente. Se cree que parte del lípido está encerrado en una disposición parecida a un meshl de cadenas peptídicas y se hace accesible para la reacción sólo después del despliegue de las cadenas por agentes desnaturalizantes.
Aunque las lipoproteínas en la fracción α y β-globulina del suero sanguíneo son solubles en agua (pero insolubles en disolventes orgánicos), algunas de las lipoproteínas cerebrales, debido a su alto contenido en lípidos, son solubles en disolventes orgánicos; Se les llama proteolípidos.
La β-lipoproteína del suero sanguíneo humano es una macroglobulina con un peso molecular de aproximadamente 1.300.000, 70 por ciento de los cuales es lípido; Del lípido, aproximadamente el 30 por ciento es fosfolípido y el 40 por ciento de colesterol y compuestos derivados de él. Debido a su contenido de lípidos, las lipoproteínas tienen la menor densidad (masa por unidad de volumen) de todas las proteínas y generalmente se clasifican como lipoproteínas de baja y alta densidad (LDL y HDL).
Las lipoproteínas coloreadas se forman mediante la combinación de proteínas con carotenoides. La crustacianina, el pigmento de langostas, cangrejos de río y otros crustáceos, contiene astaxantina, que es un compuesto derivado del caroteno. Entre las más interesantes de las lipoproteínas coloreadas están los pigmentos de la retina del ojo.
En la rodopsina, el pigmento rojo de la retina, el grupo aldehído (-CHO) de la retina forma un enlace covalente con un amino (- NH2) de opsina, el portador de proteína. La visión del color está mediada por la presencia de varios pigmentos visuales en la retina que difieren de la rodopsina ya sea en la estructura de la retina o en la del portador de la proteína.
3. Metaloproteínas
Las proteínas en las que los iones de metales pesados se unen directamente a algunas de las cadenas laterales de histidina, cisteína o algún otro aminoácido se denominan metaloproteínas. Dos metaloproteínas, la transferrina y la ceruloplasmina, se encuentran en las fracciones de globulina del suero sanguíneo; Actúan como portadores de hierro y cobre, respectivamente.
La transferrina tiene un peso molecular de aproximadamente 80.000 y consta de dos subunidades idénticas, cada una de las cuales contiene un ion férrico (Fe3 +) que parece estar unido a la tirosina. Se sabe que existen varias variantes genéticas de la transferrina en seres humanos.
Otra proteína del hierro, la ferritina, que contiene 20 a 22 por ciento de hierro, es la forma en que el hierro se almacena en los animales; Se ha obtenido en forma cristalina a partir del hígado y el bazo. Una molécula que consta de 20 subunidades, su peso molecular es de aproximadamente 480.000. El hierro se puede eliminar por reducción del estado férrico (Fe3 +) al ferroso (Fe2 +). La proteína libre de hierro, la apoferritina, se sintetiza en el cuerpo antes de incorporar el hierro.
Las plantas verdes y algunas bacterias fotosintéticas y fijadoras de nitrógeno (es decir, las bacterias que convierten el nitrógeno atmosférico, N2, en aminoácidos y proteínas) contienen varias ferredoxinas. Son pequeñas proteínas que contienen de 50 a 100 aminoácidos y una cadena de hierro y unidades disulfuro (FeS2), en la que algunos de los átomos de azufre son aportados por la cisteína; Otros son iones sulfuro (S2-).
El número de unidades de FeS2 por molécula de ferredoxina varía de cinco en la ferredoxina de espinaca a 10 en la ferredoxina de ciertas bacterias. Las ferredoxinas actúan como portadores de electrones en la fotosíntesis y en la fijación de nitrógeno.
La ceruloplasmina es una globulina que contiene cobre que tiene un peso molecular de 151.000; La molécula consta de ocho subunidades, cada una contiene un ion de cobre. La ceruloplasmina es el principal portador de cobre en los organismos, aunque el cobre también puede ser transportado por la transferrina de globulina que contiene hierro.
Otra proteína que contiene cobre, la superóxido de cobre-zinc dismutasa (anteriormente conocida como eritrocupreina), se ha aislado de glóbulos rojos; También se ha encontrado en el hígado y en el cerebro. La molécula, que consta de dos subunidades de tamaño similar, contiene iones de cobre y iones de zinc. Debido a su contenido de cobre, la ceruloplasmina y la superóxido-dismutasa de cobre-zinc poseen actividad catalítica en las reacciones de oxidación-reducción.
Muchas enzimas animales contienen iones de cinc, que suelen estar unidos al azufre de la cisteína. Los riñones de caballo contienen la proteína metalotioneína, que contiene zinc y cadmio; Ambos están ligados al azufre. Se ha encontrado un complejo de vanadio-proteína (hemovanadina) en cantidades sorprendentemente elevadas en células verde amarillentas (vanadocitos) de tunicados, que son invertebrados marinos.
4. Proteínas del grupo hemo y otras cromoproteínas
Aunque las proteínas heme contienen hierro, generalmente no se clasifican como metaloproteínas, porque su grupo protésico es un complejo de hierro-porfirina en el que el hierro se une muy firmemente. El intenso color rojo o marrón de las proteínas heme no es causado por hierro sino por porfirina, una compleja estructura cíclica. Todos los compuestos de porfirina absorben intensamente la luz en o cerca de 410 nanómetros.
La porfirina consiste en cuatro anillos de pirrol (estructuras cerradas de cinco miembros que contienen un átomo de nitrógeno y cuatro átomos de carbono) unidos entre sí por grupos metino (-CH =).
El átomo de hierro se mantiene en el centro del anillo de porfirina por interacción con los cuatro átomos de nitrógeno. El átomo de hierro puede combinarse con otros dos sustituyentes; En la oxihemoglobina, un sustituyente es una histidina del portador de la proteína, el otro es una molécula de oxígeno. En algunas proteínas heme, la proteína también está unida covalentemente a las cadenas laterales de porfirina. Las proteínas hemo se describen a continuación (ver Proteínas respiratorias).
La cromoproteína melanina, un pigmento que se encuentra en la piel oscura, cabello oscuro y tumores melanóticos, se presenta en todos los grupos principales de organismos vivos y parece ser notablemente diversa en su estructura.
En los seres humanos, la melanina producida por los melanocitos puede ser de color marrón oscuro (eumelanina) o de color rojo pálido o amarillento (phaeomelanina). Los diferentes tipos se sintetizan a través de diferentes vías, aunque comparten el mismo paso inicial: la oxidación de la tirosina.
Las cromoproteínas verdes llamadas biliproteínas se encuentran en muchos insectos, como los saltamontes, y también en las cáscaras del huevo de muchas aves. Las biliproteínas se derivan del pigmento biliar biliverdin, que a su vez se forma a partir de porfirina; Biliverdin contiene cuatro anillos de pirrol y tres de los cuatro grupos de metina de porfirina.
Se han encontrado grandes cantidades de biliproteínas en algas rojas y algas verde-azuladas; La proteína roja se llama ficoeritrina, la azul una ficocianobilina.
5. Nucleoproteínas
Cuando se mezcla una solución de proteína con una solución de un ácido nucleico, el componente de ácido fosfórico del ácido nucleico se combina con los grupos de amonio cargados positivamente (-NH3 +) de la proteína para formar un complejo de proteína-ácido nucleico.
El núcleo de una célula contiene predominantemente ácido desoxirribonucleico (ADN) y el citoplasma predominantemente ácido ribonucleico (ARN); Ambas partes de la célula también contienen proteínas. Por lo tanto, los complejos proteína-ácido nucleico se forman en células vivas.
Las únicas nucleoproteínas para las que existe alguna evidencia de especificidad son nucleoprotaminas, nucleohistonas y algunos virus de ARN y ADN. Las nucleoprotaminas son la forma en que se producen protaminas en los espermatozoides de los peces; Las histonas del timo y de las plántulas de guisantes y otros materiales vegetales aparecen aparentemente predominantemente como nucleohistones. Tanto las nucleoprotaminas como las nucleohistonas contienen sólo ADN.
Algunos de los virus más simples consisten en un ARN específico, que está recubierto por proteínas. Uno de los virus de ARN más conocidos, el virus del mosaico del tabaco (TMV), tiene la forma de una varilla. El ARN comprende sólo el 5,1 por ciento de la masa del virus.
Se ha determinado la secuencia completa de la proteína del virus, que consiste en aproximadamente 2.130 cadenas peptídicas idénticas, conteniendo cada una 158 aminoácidos. La proteína se dispone en una espiral alrededor del núcleo de ARN.
Se ha encontrado ADN en la mayoría de los virus bacterianos (bacteriófagos) y en algunos virus animales. Como en TMV, el núcleo del ADN está rodeado de proteínas. La proteína de fago es una mezcla de enzimas y por lo tanto no puede ser considerada como la porción de proteína de una sola nucleoproteína.
Proteínas respiratorias
1. Hemoglobina
La hemoglobina es el portador de oxígeno en todos los vertebrados y algunos invertebrados. En la oxihemoglobina (HbO2), que es de color rojo brillante, el ion ferroso (Fe2 +) está unido a los cuatro átomos de nitrógeno de la porfirina; Los otros dos sustituyentes son una molécula de oxígeno y la histidina de la globina, el componente proteico de la hemoglobina.
La desoxihemoglobina (desoxi-Hb), como su nombre indica, es oxihemoglobina menos oxígeno (es decir, hemoglobina reducida); Es de color púrpura. La oxidación del ion ferroso de la hemoglobina produce un compuesto férrico, methemoglobina, a veces llamada hemiglobina o ferrihemoglobina. El oxígeno de la oxihemoglobina puede ser desplazado por el monóxido de carbono, para el cual la hemoglobina tiene una afinidad mucho mayor, impidiendo que el oxígeno alcance los tejidos del cuerpo.

Las hemoglobinas de todos los mamíferos, aves y muchos otros vertebrados son tetrámeros de dos cadenas α y dos β. El peso molecular del tetrámero es de 64.500; El peso molecular de las cadenas α y β es de aproximadamente 16.100 cada uno, y las cuatro subunidades están unidas entre sí mediante interacciones no covalentes.
Si se elimina la hemin (el componente de porfirina férrica) de la globina (el componente proteico), se obtienen dos moléculas de globina, cada una de las cuales consta de una cadena α y una cadena β; El peso molecular de la globina es de 32.200. En contraste con la hemoglobina, la globina es una proteína inestable que se desnaturaliza fácilmente.
Si la globina nativa se incuba con una solución de hemina a valores de pH de 8 a 9, se reconstituye la hemoglobina nativa. La mioglobina, el pigmento rojo de los músculos de los mamíferos, es un monómero con un peso molecular de 16.000.
Las hemoglobinas de mamíferos difieren entre sí en su composición de aminoácidos y por lo tanto en su estructura secundaria y terciaria. Las hemoglobinas de rata y de caballo cristalizan muy fácilmente, pero las de los seres humanos, el ganado y las ovejas, porque son más solubles, son difíciles de cristalizar. La forma de los cristales de hemoglobina varía en diferentes especies; Además, la descomposición y la desnaturalización se producen a diferentes velocidades en diferentes especies.
También se encontró que la sangre de los recién nacidos humanos contiene dos hemoglobinas diferentes: aproximadamente el 20 por ciento de su hemoglobina es una hemoglobina adulta (hemoglobina A) y el 80 por ciento es una hemoglobina fetal (hemoglobina F). La hemoglobina F persiste en el lactante durante los primeros siete meses de vida. La misma hemoglobina F también se ha encontrado en la sangre de los pacientes que padecen talasemia, una anemia con alta incidencia en las regiones que rodean al Mar Mediterráneo.
La hemoglobina F contiene, al igual que la hemoglobina A, dos cadenas α; Las dos cadenas β, sin embargo, han sido reemplazadas por dos cadenas γ bastante diferentes. Cuando la técnica de electroforesis se aplicó por primera vez a la hemoglobina de los negros que padecían anemia falciforme en 1949, se descubrió una nueva hemoglobina (hemoglobina S).
Desde entonces se han descubierto más de 200 hemoglobinas humanas diferentes. Se diferencian de la hemoglobina A normal en la composición de aminoácidos de la cadena α o β.
Las hemoglobinas de algunos de los peces más bajos son monómeros que contienen un átomo de hierro por molécula. Se han encontrado proteínas respiratorias similares a la hemoglobina en algunos invertebrados. La hemoglobina roja de insectos, moluscos y protozoos se llama eritrocruorina. Se diferencia de la hemoglobina vertebrada por su alto peso molecular.
Aunque las plantas verdes no contienen hemoglobina, una proteína roja, llamada leghemoglobina, se ha descubierto en los nódulos radiculares de las plantas leguminosas. Parece ser producida por las bacterias fijadoras de nitrógeno de los nódulos radiculares y puede estar implicada en la reducción del nitrógeno atmosférico en amoníaco y aminoácidos.
2. Otras proteínas respiratorias
Una proteína respiratoria verde, chlorocruorin, se ha encontrado en la sangre de gusanos marinos en los géneros Serpula y Spirographis. Tiene el mismo peso molecular alto que la eritrocruorina pero difiere de la hemoglobina en su grupo protésico.
Una metaloproteína roja, la hemeritrina, actúa como una proteína respiratoria en los gusanos marinos del filo Sipuncula. La molécula consta de ocho subunidades con un peso molecular de 13.500 cada una. Hemeritrina no contiene porfirinas y por lo tanto no es una proteína heme.
Una metaloproteína que contiene cobre es la proteína respiratoria de los crustáceos (camarones, cangrejos, etc.) y de algunos gasterópodos (caracoles). La proteína, llamada hemocinina, es amarillo pálido cuando no se combina con oxígeno, y azul cuando se combina con oxígeno. Los pesos moleculares de las hemocyaninas varían de 300.000 a 9.000.000. Cada animal investigado hasta ahora parece tener una hemocianina específica de la especie.
Hormonas proteicas
Algunas hormonas que son productos de las glándulas endocrinas son proteínas o péptidos, otras son esteroides. (El origen de las hormonas, su función fisiológica y su modo de acción se tratan en la hormona del artículo). Ninguna de las hormonas tiene actividad enzimática. Cada uno tiene un órgano diana en el que provoca alguna acción biológica, por ejemplo, secreción de jugo gástrico o pancreático, producción de leche, producción de hormonas esteroideas.
El mecanismo por el cual las hormonas ejercen sus efectos no se entiende completamente. El adenosina monofosfato cíclico está implicado en la transmisión del estímulo hormonal a las células cuya actividad es aumentada específicamente por la hormona.
Hormonas de la glándula tiroides
La tiroglobulina, cuyos grupos activos son dos moléculas del compuesto que contiene yodo tiroxina, tiene un peso molecular de 670.000. La tiroglobulina también contiene tiroxina con dos y tres átomos de yodo en lugar de cuatro y tirosina con uno y dos átomos de yodo. La inyección de la hormona causa un aumento en el metabolismo; La falta de resultados en una desaceleración.
Otra hormona, la calcitonina, que disminuye el nivel de calcio de la sangre, se produce en la glándula tiroides. Las secuencias de aminoácidos de calcitonina de cerdo, vaca y salmón difieren de la calcitonina humana en algunos aminoácidos. Todos ellos, sin embargo, tienen las semi-cistinas (C) y la prolinamida (P) en la misma posición.
La hormona paratiroidea (parathormone), producida en las pequeñas glándulas que están incrustadas o se encuentran detrás de la glándula tiroides, es esencial para mantener el nivel de calcio de la sangre. Una disminución en su producción produce hipocalcemia (una reducción de los niveles de calcio en el torrente sanguíneo por debajo del rango normal). La paraformonona bovina tiene un peso molecular de 8.500; No contiene cistina ni cisteína y es rica en ácido aspártico, ácido glutámico o sus amidas.
Hormonas del páncreas
Aunque la estructura de aminoácidos de la insulina se ha conocido desde 1949, los intentos repetidos de sintetizar dio rendimientos muy pobres debido al fallo de las dos cadenas peptídicas para combinar formando el puente disulfuro correcto.
La facilidad de la biosíntesis de la insulina se explica por el descubrimiento en el páncreas de la proinsulina, a partir de la cual se forma la insulina. La única cadena peptídica de proinsulina pierde un péptido que consta de 33 aminoácidos y se llama el péptido de conexión, o péptido C, durante su conversión a insulina. Los puentes disulfuro de proinsulina conectan las cadenas A y B.

En soluciones acuosas, la insulina existe predominantemente como un complejo de seis subunidades, cada una de las cuales contiene una cadena A y una cadena B. Se han aislado y analizado las insulinas de varias especies; Se ha encontrado que sus secuencias de aminoácidos difieren algo, pero todas contienen aparentemente los mismos puentes disulfuro entre las dos cadenas.
Aunque la inyección de insulina disminuye el azúcar en la sangre, la administración de glucagón, otra hormona pancreática, eleva el nivel de azúcar en la sangre. El glucagón consiste en una cadena peptídica recta de 29 aminoácidos. Se ha sintetizado; El producto sintético tiene la actividad biológica completa del glucagón natural. La estructura del glucagón está libre de cistina e isoleucina.
La glándula pituitaria tiene un lóbulo anterior, un lóbulo posterior y una porción intermedia; Difieren en la estructura celular y en la estructura y la acción de las hormonas que forman. El lóbulo posterior produce dos hormonas similares, la oxitocina y la vasopresina. La primera causa la contracción del útero grávido; Este último aumenta la presión arterial.
Ambos son octapéptidos formados por un anillo de cinco aminoácidos (las dos mitades de cistina cuentan como un aminoácido) y una cadena lateral de tres aminoácidos. Las dos mitades de cistina están unidas entre sí por un enlace disulfuro, y el aminoácido C terminal es glicinamida. La estructura se ha establecido y confirmado. La vasopresina humana difiere de la oxitocina en que la isoleucina se sustituye por la fenilalanina y la leucina por la arginina.

La parte intermedia de la glándula pituitaria produce la hormona estimulante de los melanocitos (MSH), que causa la expansión de los melanóforos pigmentados (células) en la piel de las ranas y otros batracios.
Dos hormonas, llamadas α-MSH y β-MSH, se han preparado a partir de glándulas pituitarias de cerdo. El primero, α-MSH, consta de 13 aminoácidos; Su serina N-terminal está acetilada (es decir, el grupo acetilo, CH3CO, del ácido acético está unido), y su residuo valina C terminal está presente como valinamida. El segundo, β-MSH, contiene en sus 18 aminoácidos muchos de los que ocurren en α-MSH.

El lóbulo de la pituitaria anterior produce varias hormonas proteínicas: una hormona estimulante del tiroides (tirotropina), peso molecular de 28.000; Una hormona lactogénica, peso molecular 22.500; Una hormona de crecimiento, peso molecular 21.500; Una hormona luteinizante, peso molecular 30.000; Y una hormona folículo-estimulante, peso molecular 29.000. La hormona estimulante de la tiroides consiste en subunidades α y β con una composición similar a las subunidades de la hormona luteinizante.
Cuando se separan, ninguna de las dos subunidades tiene actividad hormonal; Cuando se combinan, sin embargo, recuperan alrededor del 50 por ciento de la actividad original.
La hormona lactogénica (prolactina) de glándulas pituitarias de ovejas contiene 190 aminoácidos. Su secuencia ha sido aclarada; Una cadena peptídica similar de 188 aminoácidos que se ha sintetizado no sólo tiene 10 por ciento de la actividad biológica de la hormona natural sino también alguna actividad de la hormona del crecimiento.
También se conoce la secuencia de aminoácidos de la hormona del crecimiento (hormona somatotrópica); Parece estimular la síntesis de ARN y de esta manera acelerar el crecimiento. La hormona luteinizante, una mucoproteína que contiene aproximadamente 12 por ciento de carbohidratos, consiste en dos subunidades, cada una con un peso molecular de aproximadamente 15.000; Cuando se separan, las subunidades se recombinan espontáneamente.
La orina de las mujeres embarazadas contiene gonadotropina coriónica, cuya presencia hace posible el diagnóstico precoz del embarazo. La secuencia de aminoácidos es conocida.
La secuencia de 160 de sus 190 aminoácidos es idéntica a la de la hormona del crecimiento; 100 de estos también ocurren en la misma secuencia que en la hormona lactogénica. Las diferentes hormonas pituitarias y la gonadotropina coriónica pueden así derivarse de una sustancia común que, durante la evolución, se sometió a diferenciación.
Péptidos con actividad hormonal
Se han descubierto pequeños péptidos que, como las hormonas, actúan sobre ciertos órganos diana. Un péptido, la angiotensina (angiotonina o hipertensina), se forma en la sangre de angiotensinógeno por la acción de la renina, una enzima del riñón. Es un octapéptido y aumenta la presión arterial.
Los péptidos similares incluyen la bradiquinina, que estimula los músculos lisos; Gastrina, que estimula la secreción de ácido clorhídrico y pepsina en el estómago; Secretina, que estimula el flujo del jugo pancreático; Y la calicreína, cuya actividad es similar a la bradiquinina.
Inmunoglobulinas y anticuerpos
Los anticuerpos, proteínas que combaten sustancias extrañas en el cuerpo, se asocian con la fracción de globulina del suero inmune. Como se ha indicado anteriormente, cuando las globulinas séricas se separan en fracciones α-, β- y γ-, los anticuerpos están asociados con las γ-globulinas. Los anticuerpos pueden purificarse por precipitación con el antígeno (es decir, la sustancia extraña) que causó su formación, seguido por la separación del complejo antígeno-anticuerpo.
Los anticuerpos preparados de esta manera consisten en una mezcla de muchas moléculas de anticuerpo similares, que difieren en peso molecular, composición de aminoácidos y otras propiedades. Las mismas diferencias se encuentran en las γ-globulinas de los sueros sanguíneos normales. Se cree que la γ-globulina del suero sanguíneo normal consiste en una mezcla de cientos de diferentes γ-globulinas, cada una de las cuales ocurre en cantidades demasiado pequeñas para el aislamiento.
Debido a que las propiedades físicas y químicas de las globulinas γ normales son las mismas que las de los anticuerpos, las γ-globulinas se denominan frecuentemente inmunoglobulinas. Pueden considerarse anticuerpos contra antígenos desconocidos. Si las soluciones de γ-globulina se resuelven mediante filtración en gel a través de dextrano, la primera fracción tiene un peso molecular de 900.000.
Esta fracción se denomina IgM o γM; Ig es una abreviatura de inmunoglobulina y M para macroglobulina. Las dos fracciones siguientes son IgA (γA) e IgG (γG), con pesos moleculares de aproximadamente 320.000 y 150.000, respectivamente. Otras dos inmunoglobulinas, conocidas como IgD e IgE, también se han detectado en cantidades mucho menores en algunos sueros inmunes.
La mayor parte de las inmunoglobulinas se encuentra en la fracción IgG, que también contiene la mayoría de los anticuerpos. Las moléculas de IgM son aparentemente pentamers-agregados de cinco de las moléculas de IgG. La microscopía electrónica muestra que sus cinco subunidades están unidas entre sí por enlaces disulfuro en forma de pentágono. Las moléculas de IgA se encuentran principalmente en la leche y en las secreciones de la mucosa intestinal.
Algunos de ellos contienen, además de un dímero de IgG, una "pieza secretora" que permite el paso de moléculas de IgA entre tejido y fluido; La estructura de la pieza secretora aún no se conoce. Las inmunoglobulinas IgM e IgA y los anticuerpos contienen de 10 a 15 por ciento de carbohidratos; El contenido en carbohidratos de las moléculas de IgG es de 2 a 3 por ciento.
Las moléculas de IgG tratadas con la enzima papaína se dividieron en tres fragmentos de peso molecular casi idéntico de 50.000. Dos de ellos, llamados fragmentos Fab, son idénticos; El tercero es abreviado Fc. La reducción a grupos sulfhidrilo de algunos de los enlaces disulfuro de IgG da lugar a la formación de dos cadenas pesadas, o cadenas H (peso molecular 55.000) y dos cadenas ligeras o L (peso molecular 22.000). Están unidos por enlaces disulfuro en el orden L-H-H-L. Cada cadena H contiene cuatro enlaces disulfuro intracadena, y cada cadena L contiene dos.

Las preparaciones de anticuerpos del tipo IgG, incluso después de la eliminación de los anticuerpos IgM e IgA, son heterogéneas. Las cadenas H y L consisten en un gran número de diferentes cadenas L y una variedad de cadenas H. Sin embargo, las inmunoglobulinas IgG, IgM e IgA puras se producen en el suero sanguíneo de pacientes que sufren de mielomas, que son tumores malignos de la médula ósea.
Los tumores producen una IgG, una IgM, o una proteína IgA, pero rara vez más de una clase. Una proteína llamada proteína Bence-Jones, que se encuentra en la orina de pacientes que sufren de tumores de mieloma, es idéntica a las cadenas L de la proteína del mieloma.
Cada paciente tiene una proteína Bence-Jones diferente; No hay dos de las más de 100 proteínas Bence-Jones que se han analizado hasta ahora son idénticos. Se cree que una célula linfoide entre cientos de miles se convierte en maligna y se multiplica rápidamente, formando la masa de un tumor de mieloma que produce una γ-globulina.
Los análisis de las proteínas Bence-Jones han revelado que las cadenas L de los seres humanos y otros mamíferos son de dos tipos muy diferentes, kappa (κ) y lambda (λ). Ambos consisten en aproximadamente 220 aminoácidos. Las mitades N-terminales de las cadenas κ y λ son variables, que difieren en cada proteína Bence-Jones. Las mitades C-terminales de estas mismas cadenas L tienen una secuencia de aminoácidos constante del tipo κ o λ.
El hecho de que la mitad de una cadena peptídica es variable y la otra mitad invariante es contradictoria con la opinión de que la secuencia de aminoácidos de cada cadena peptídica está determinada por un gen.
Evidentemente, dos genes, uno de ellos variable, el otro invariante, se fusionan para formar el gen de la única cadena peptídica de las cadenas L. Mientras que las cadenas L humanas normales son siempre mezclas de los tipos κ y λ, las cadenas H de IgG, IgM e IgA son diferentes. Han sido designados como cadenas gamma (γ), mu (μ) y alfa (α), respectivamente.
El cuarto N-terminal de las cadenas H tiene una secuencia de aminoácidos variable; Los tres cuartos C-terminales de las cadenas H tienen una secuencia de aminoácidos constante.
Algunas de las secuencias de aminoácidos en las cadenas L y H se transmiten de generación en generación. Como resultado, la porción constante de las cadenas L humanas del tipo κ tiene en posición 191 valina o leucina. Corresponden a dos alelos (porciones determinantes de caracteres) de un gen; Los dos tipos se llaman allotypes. El tipo genético que contiene valina ha sido designado como InV (a +), el tipo que contiene leucina como InV (b +).
Se han encontrado muchos más alotipos, llamados alotipos Gm, en las cadenas gamma de las inmunoglobulinas IgG humanas; Se conocen más de 20 gm de alotipos. Ciertas combinaciones de tipos Gm ocurren. Por ejemplo, la combinación de Gm tipos 5, 6 y 11 se ha encontrado en caucásicos y afroamericanos, pero no en chino; La combinación de 1, 2 y 17 no se ha encontrado en afroamericanos; Y la combinación de 1, 4, y 17 no se ha encontrado en los caucásicos. También se ha descubierto que los alotipos se producen en un número de otros animales, incluyendo conejos y ratones.
Es comprensible por la aparición de un gran número de alotipos que los anticuerpos, incluso si se producen en respuesta a un único antígeno, son mezclas de diferentes alotipos. La existencia de varias clases de anticuerpos, de diferentes alotipos, y de adaptación de las porciones variables de anticuerpos a diferentes regiones de una molécula de antígeno da como resultado una multiplicidad de moléculas de anticuerpo incluso si se administra sólo un antígeno.
Por esta razón, todavía no ha sido posible desentrañar la secuencia de aminoácidos en la porción variable de moléculas de anticuerpo. Sin embargo, gran parte de la secuencia de aminoácidos en las regiones constantes de las cadenas L y H de los seres humanos y las inmunoglobulinas de conejo ha sido resuelta.
Proteína: estructura general y propiedades de las proteínas
Para conocer la estructura general de las proteínas y sus propiedades, haciendo clic en este enlace podrás leer toda la información al respecto.
Referencia: https://www.britannica.com/science/protein/Conformation-of-proteins-in-interfaces#toc72547
